Determination of Residues of 7 Pyridine Pesticides in Rice and Wheat by Ultra-High Performance Liquid Chromatography-Tandem Mass Spectrometry with QuEChERS
-
摘要:
考虑到标准方法GB 23200.50—2016测定时前处理过程较为复杂,采用题示方法测定大米和小麦中氟硫草定、吡虫啉、氟啶草酮、噻唑烟酸、咪唑乙烟酸、啶虫脒和啶酰菌胺等7种吡啶类农药的残留量。取适量大米或小麦样品,粉碎,过筛后分取2.00 g,加入5 mL水,涡旋混匀,静置30 min。加入10 mL乙腈和2 g氯化钠,涡旋5 min,离心5 min。收集上清液,转移至盛有300 mg C18和2.0 g无水硫酸钠的15 mL离心管中,涡旋1 min,离心5 min,过0.22 μm亲水聚四氟乙烯针式过滤器,滤液采用超高效液相色谱-串联质谱法测定。在色谱分析中,以Shimadzu shim-pack GIST C18色谱柱作固定相,不同体积比的乙腈和0.05%(体积分数)甲酸溶液的混合溶液作流动相进行梯度洗脱;在质谱分析中,以电喷雾离子源正离子(ESI+)模式电离,多反应监测(MRM)模式检测,基质匹配法定量。结果显示:啶酰菌胺的质量浓度在2.0~50.0 μg·L−1,其他6种农药的质量浓度在1.0~50.0 μg·L−1内和对应的峰面积呈线性关系,测定下限(10S/N)为0.010 mg·kg−1(啶酰菌胺)和0.005 mg·kg−1(其他6种农药)。在0.01,0.05,0.2 mg·kg−1加标浓度水平下,7种吡啶类农药的回收率为74.6%~103%,测定值的相对标准偏差(n=6)为0.84%~6.9%,和GB 23200.50—2016的[回收率为72.1%~99.7%,测定值的相对标准偏差(n=6)为1.1%~6.8%]基本一致,说明将GB 23200.50—2016中的固相萃取法转换为QuEChERS是可行的,且QuEChERS前处理过程简单、快速,更适合批量样品的检测。
Abstract:Considering the complexity of the pre-processing process for standard methods of GB 23200.50—2016, the title method was used to determine the residue of 7 pyridine pesticides, including dithiopyr, imidacloprid, fluridone, thiazopyr, imazethapyr, acetamiprid and boscalid, in rice and wheat. An appropriate amount of rice or wheat samples was taken, crushed, and sieved. An aliquot (2.00 g) was taken, and 5 mL of water was added. The mixture was mixed well by vortex and settled for 30 min, and 10 mL of acetonitrile and 2 g of sodium chloride were added. The mixture was vortexed for 5 min, and centrifuged for 5 min. The supernatant was collected, and transferred to a 15 mL-centrifuge tube containing 300 mg of C18 and 2.0 g of anhydrous sodium sulfate. The mixture was vortexed for 1 min, centrifuged for 5 min, and passed through a 0.22 μm hydrophilic PTFE syringe filter. The filtrate was determined by ultra-high performance liquid chromatography-tandem mass spectrometry. In chromatographic analysis, Shimadzu shim-pack GIST C18 chromatographic column was used as the stationary phase, and a mixture of acetonitrile and 0.05% (volume fraction) formic acid solution at different volume ratios was used as the mobile phase for gradient elution. In the mass spectrometry analysis, the ESI+ mode was used for ionization, the MRM mode was used for detection, and the matrix matching method was used for quantification. It was shown that linear relationships between values of the mass concentration and corresponding peak area were kept in the ranges of 2.0-50.0 μg·L−1 for boscalid and 1.0-50.0 μg·L−1 for the other 6 pesticides, with lower limits of determination (10S/N) of 0.010 mg·kg−1 for boscalid and 0.005 mg·kg−1 for the other 6 pesticides. At the spiked concentration levels of 0.01, 0.05, 0.2 mg·kg−1, the recoveries of 7 pyridine pesticides were found in the range of 74.6%-103%, and RSDs (n=6) of the determined values ranged from 0.84% to 6.9%, which were basically consistent with those (the recoveries were 72.1%-99.7%, and RSDs (n=6) of the determined values were 1.1%-6.8%) given from GB 23200.50—2016, indicating that converting the solid phase extraction method in GB 23200.50—2016 to QuEChERS was feasible, and the pre-processing process of QuEChERS was simple, fast, and more suitable for detection of batch samples.
-
稻谷和小麦是我国主要的粮食作物,其生长环境湿润、温度高,遭受杂草和病虫害较多。吡啶类农药[1]作为一种含氮杂环有机化合物,因具有高效、低毒,对人和生物有良好的环境相容性等特点常常被用作稻谷和小麦的除草剂、杀菌剂和除虫剂[2-3],从而保证稻谷和小麦作物的产量和品质。但是,当农药被长期、大量使用时,会残存在稻谷和小麦中,进而通过食物链蓄积在人体内,对身体健康造成潜在危害[4-5]。为了规范用药,加强对大米和小麦质量安全的监管,国家市场监督管理总局等部门制定了国家标准GB 2763—2021《食品安全国家标准 食品中农药最大残留限量》,对吡虫啉、啶虫脒、咪唑乙烟酸、啶酰菌胺等农药进行了最大残留限量要求。
粮食作物基质较为复杂,在进行农药残留测定之前需要进行前处理操作。目前,应用于农药残留检测的前处理方法有分散固相萃取法[6-7]、固相萃取法[8-9]、固相微萃取法[10]和QuEChERS[11-12]等。其中,QuEChERS相较固相萃取法具有快速、简单、成本低、高效、稳定和安全等优点,在农药残留前处理中发挥着重要作用,被AOAC Official Method 2007.01 Pesticide Residues in Foods by Acetonitrile Extraction and Partitioning with Magnesium Sulfate Gas Chromatography/Mass Spectrometry and Liquid Chromatography/Tandem Mass Spectrometry、EN 15662:2018 Foods of Plant Origin—Multimethod for the Determination of Pesticide Residues Using GC-and LC-Based Analysis Following Acetonitrile Extraction/Partitioning and Clean-Up by Dispersive SPE-Modular QuEChERS-Method、GB 23200.121—2021《食品安全国家标准 植物源性食品中331种农药及其代谢物残留量的测定 液相色谱-质谱联用法》等多项标准采纳。
检测大米和小麦中除草剂、杀菌剂和除虫剂的国家标准有GB 23200.50—2016《食品安全国家标准 食品中吡啶类农药残留量的测定 液相色谱-质谱/质谱法》[13]、GB 23200.121—2021等。其中,GB 23200.50—2016采用固相萃取法对样品进行前处理,操作较为费时。为了简化前处理过程,提高检测效率,本工作拟将固相萃取法替换为QuEChERS,以QuEChERS提取大米、小麦中杀虫剂(啶虫脒、吡虫啉)、杀菌剂(啶酰菌胺)和除草剂(噻唑烟酸、咪唑乙烟酸、氟硫草定、氟啶草酮)等7种吡啶类农药,超高效液相色谱-串联质谱法测定,并将方法学参数与GB 23200.50—2016的进行对照,取得了满意结果。
1. 试验部分
1.1 仪器与试剂
LCMS-8045型超高效液相色谱-三重四极杆串联质谱仪,配备电喷雾离子源和大气压化学离子源;0.22 μm亲水聚四氟乙烯(PTFE)针式过滤器;0.45 μm有机滤膜;15,50 mL塑料具塞离心管;E0AA-HM-01型多管旋涡混合器;H2050R型高速冷冻离心机;JJ300S型电子天平;Synergy型超纯水仪。
单标准溶液:1 000 mg·L−1,包括氟硫草定(CAS号97886-45-8)、吡虫啉(CAS号138261-41-3)、氟啶草酮(CAS号59756-60-4)、噻唑烟酸(CAS号70239-82-6)、咪唑乙烟酸(CAS号81385-77-5)、啶虫脒(CAS号135410-20-7)和啶酰菌胺(CAS号188425-85-6)。
混合标准储备溶液:分别移取适量的各单标准溶液置于盛有部分乙腈的25 mL容量瓶中,用乙腈稀释至刻度,配制成10 mg·L−1的混合标准储备溶液,于−18 ℃储存。
混合标准中间液:准确移取适量的混合标准储备溶液置于盛有适量乙腈的25 mL容量瓶中,用乙腈稀释至刻度,配制成1 000 μg·L−1的混合标准中间液,于0~4 ℃储存。
混合标准溶液系列:使用乙腈逐级稀释混合标准中间液,配制成1.0,2.0,5.0,10.0,20.0,50.0 μg·L−1的混合标准溶液系列,现用现配。
基质匹配混合标准溶液系列:使用空白基质溶液逐级稀释混合标准中间液,配制成1.0,2.0,5.0,10.0,20.0,50.0 μg·L−1的基质匹配混合标准溶液系列,现用现配。
乙腈为色谱纯;无水硫酸钠、无水硫酸镁和氯化钠均为分析纯;十八烷基硅烷键合硅胶(C18),粒径为40 μm;石墨化碳黑(GCB),粒径为100~300目(0.048~0.15 mm)和N-丙基乙二胺(PSA),粒径为60 μm;试验用水为一级水。
1.2 仪器工作条件
1.2.1 色谱条件
Shimadzu shim-pack GIST C18色谱柱(50 mm×2.1 mm,2 μm);柱温40 ℃;流动相A为乙腈,B为0.05%(体积分数,下同)甲酸溶液,流量3 mL·min−1;进样量2 μL。梯度洗脱程序:0~2.0 min,A由15%升至85%,保持1.5 min;3.5~3.6 min,A由85%跳转至15%,保持1.4 min。
1.2.2 质谱条件
电喷雾离子(ESI)源,正离子(ESI+)模式;加热气流量10 L·min−1,雾化气流量3 L·min−1,干燥气流量10 L·min−1;脱溶剂温度526 ℃,接口温度300 ℃,脱溶剂管温度250 ℃,加热块温度400 ℃;多反应监测(MRM)检测。其他质谱参数见表1,其中“*”为定量离子。
表 1 质谱参数Table 1. MS parameters序号 农药 保留时间/min 母离子质荷比(m/z) 特征离子对m/z 碰撞能量/eV 1 吡虫啉 1.751 256.05 175.10*/209.05 17/14 2 啶虫脒 1.809 223.10 126.05*/56.10 22/15 3 咪唑乙烟酸 1.932 290.10 245.10*/177.05 19/26 4 氟啶草酮 2.445 330.05 309.05*/310.05 35/28 5 啶酰菌胺 2.563 343.00 307.10*/271.10 18/30 6 噻唑烟酸 2.850 397.20 376.90*/334.90 24/31 7 氟硫草定 3.022 402.00 354.10*/272.10 18/30 1.3 试验方法
1.3.1 样品预处理
取适量大米、小麦样品,使用高速粉碎机粉碎后过425 μm筛,于常温保存。
1.3.2 样品前处理和测定
称取2 g(精确至0.01 g)粉碎好的大米、小麦样品,置于50 mL塑料离心管中,加入5 mL水后涡旋混匀,静置30 min。再加入10 mL乙腈和2 g氯化钠,以2 500 r·min−1速率涡旋混合5 min,6 000 r·min−1转速离心5 min。收集上清液,转移至盛有300 mg C18和2.0 g无水硫酸钠的15 mL塑料离心管中,涡旋混合1 min,以6 000 r·min−1转速离心5 min,用0.22 μm亲水PTFE针式过滤器过滤,滤液按照仪器工作条件测定。
2. 结果与讨论
2.1 色谱及质谱条件的优化
虽然7种农药结构中都含有氮原子,具有一定的电负性,但是相对于负离子模式,ESI+模式扫描更易形成准分子离子[M+H]+。在确定7种农药的母离子后,对母离子进行二级质谱扫描,并进行碰撞能量的优化,选择稳定且丰度较高的离子对作为特征离子对。优化后的质谱参数见表1。
以Shimadzu shim-pack GIST C18色谱柱作固定相,试验比较了分别以乙腈、甲醇作有机相,水、0.05%甲酸溶液、0.1%(体积分数,下同)甲酸溶液作水相时7种农药的分离效果。结果显示:以乙腈作有机相时,7种农药的峰形优于以甲醇作有机相时的;以0.05%甲酸溶液作水相时,7种农药的分离度较好,且具有良好的峰形。因此,试验选择乙腈-0.05%甲酸溶液体系作流动相。
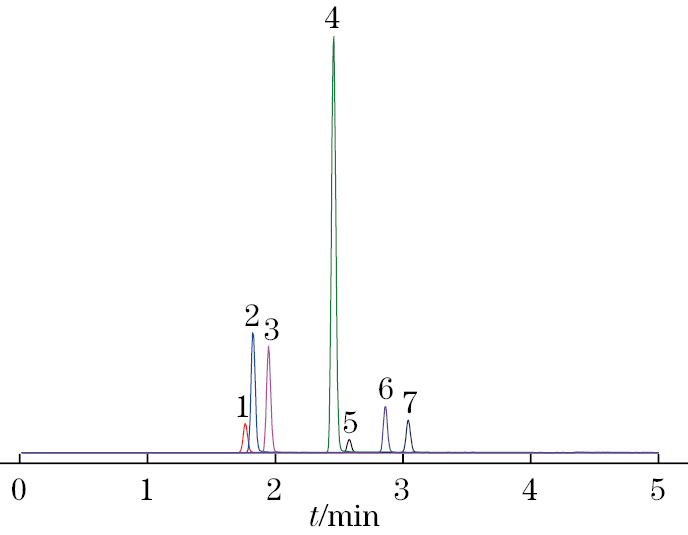
在优化的仪器工作条件下,7种农药的总离子流色谱图见图1。
由图1可知,7种农药均在3.5 min以内全部出峰,仪器分析时间在5 min以内,检测效率较高。
2.2 样品前处理的优化
2.2.1 提取条件
在进行农产品中农药残留的检测时,常使用乙腈、丙酮和乙酸乙酯等作提取溶剂,为减少后续溶剂置换,试验考察了乙腈或含0.1%(体积分数,下同)乙酸的乙腈溶液的提取效果。结果显示,采用含0.1%乙酸的乙腈溶液提取时,咪唑乙烟酸基本提取不出来,其余农药回收率和乙腈提取时的基本相同。考虑到乙腈的提取率均较高(回收率在70.0%~110%内),试验选择乙腈作提取溶剂。
在提取过程中加入适量氯化钠可以促进水相和有机相的分离,而大米和小麦含水量过低,为提升农药的提取率,试验选择在提取前加入5 mL水并静置30 min后再加入氧化钠2 g。
2.2.2 净化剂及其用量
QuEChERS常用PSA、C18和GCB进行净化,用于去除提取液中色素等干扰物质。但是,使用PSA净化时,咪唑乙烟酸的回收率几乎为0;使用GCB净化时,7种农药的回收率均在50.0%~120%内,个别农药的回收率较低;使用C18净化时,7种农药的回收率均在70.0%~120%内。无水硫酸镁和无水硫酸钠均可用于去除提取液中的水分,但是使用无水硫酸镁除水时,咪唑乙烟酸的回收率几乎为0,而无水硫酸钠所得7种农药的回收率均较优(70.0%~110%内)。因此,试验选择C18联合无水硫酸钠净化样品提取液。
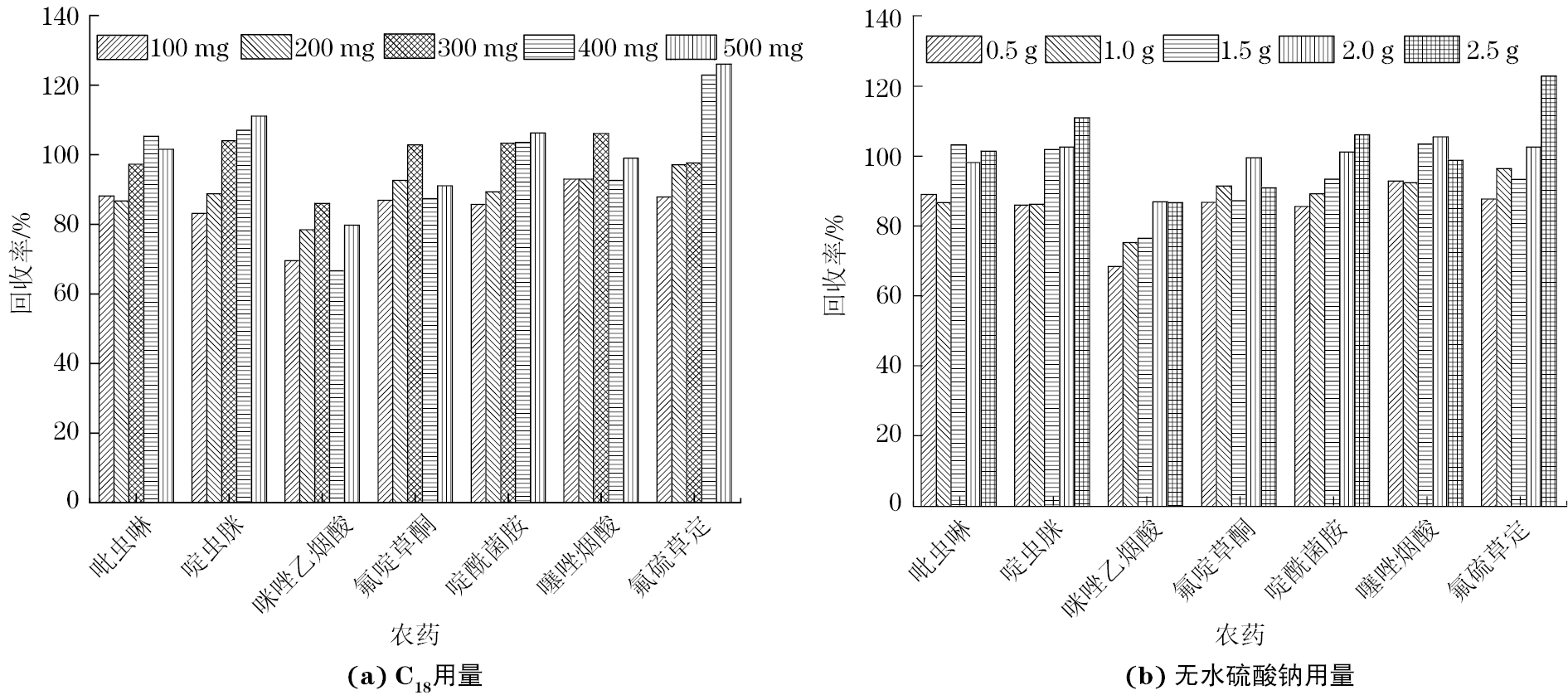
试验进一步考察了C18用量分别为100,200,300,400,500 mg,无水硫酸钠用量分别为0.5,1.0,1.5,2.0,2.5 g时对加标大米样品(加标量0.05 mg·kg−1)中7种农药回收率的影响,结果见图2。
结果显示:C18用量为300 mg、无水硫酸钠用量为2.0 g时7种农药的回收率总体较优,因此试验选择采用该用量组合进行样品净化。
2.3 方法学验证
2.3.1 标准曲线、基质效应和测定下限
按照仪器工作条件测定基质匹配混合标准溶液系列和混合标准溶液系列,以各农药的质量浓度为横坐标,对应的峰面积为纵坐标绘制标准曲线,线性参数见表2。参考文献[14-15],以基质匹配标准曲线斜率和溶剂标准曲线斜率的比值计算基质效应(ME)值,结果见表2。
表 2 线性参数、ME值和测定下限Table 2. Linearity parameters, ME values and lower limits of determination农药 标准曲线类型 线性范围ρ/(μg·L−1) 线性回归方程 相关系数 ME值 测定下限w/(mg·kg−1) 吡虫啉 溶剂 1.0~50.0 y=6.285×103x−3.964×102 0.999 8 1.28 0.005 基质匹配 1.0~50.0 y=8.063×103x+3.698×102 0.999 9 啶虫脒 溶剂 1.0~50.0 y=3.482×104x+7.360×102 0.999 9 0.67 0.005 基质匹配 1.0~50.0 y=2.341×104x+1.390×103 0.999 9 咪唑乙烟酸 溶剂 1.0~50.0 y=2.636×104x−6.919×102 0.999 9 1.17 0.005 基质匹配 1.0~50.0 y=3.084×104x+1.478×103 0.999 5 氟啶草酮 溶剂 1.0~50.0 y=9.405×104x−5.239×102 0.999 4 1.06 0.005 基质匹配 1.0~50.0 y=9.946×104x−9.891×103 0.999 9 啶酰菌胺 溶剂 2.0~50.0 y=4.335×103x−2.198×102 0.999 9 1.13 0.010 基质匹配 2.0~50.0 y=4.892×103x−2.730 0.999 8 噻唑烟酸 溶剂 1.0~50.0 y=1.130×104x+3.282×102 0.999 9 1.29 0.005 基质匹配 1.0~50.0 y=1.462×104x−2.003×102 0.999 9 氟硫草定 溶剂 1.0~50.0 y=1.064×104x−6.371×102 0.999 8 0.89 0.005 基质匹配 1.0~50.0 y=9.421×103x+2.020×10 0.999 7 以10倍信噪比(S/N)计算测定下限(10S/N),结果见表2。
结果显示:7种农药的线性范围和GB 23200.50—2016的基本相同,相关系数均大于0.999 0,表明各农药的线性关系均较好;ME值在0.67~1.29内,其中啶虫脒的ME值小于0.80,表现为基质抑制效应,吡虫啉和噻唑烟酸的ME值大于1.20,表现为基质增强效应,这与文献[12]报道的一致,其他4种农药的基质效应不太明显,为了保证检测结果的准确度,试验采用基质匹配法进行定量;啶酰菌胺的测定下限为0.010 mg·kg−1,其他6种农药的测定下限均为0.005 mg·kg−1,与GB 23200.50—2016中测定下限(0.005 mg·kg−1)基本相同,但是本方法采用QuEChERS提取,不用浓缩即可直接净化,提高了检测效率。
2.3.2 精密度和回收试验
分别采用本方法和标准方法GB 23200.50—2016对空白大米和小麦样品进行低、中、高等3个浓度水平的加标回收试验,每个浓度水平平行测定6次,计算回收率和测定值的相对标准偏差(RSD),结果见表3。
农药 加标量w/(mg·kg−1) 本方法 标准方法 大米 小麦 大米 小麦 回收率/% RSD/% 回收率/% RSD/% 回收率/% RSD /% 回收率/% RSD/% 吡虫啉 0.01 90.8 6.6 84.0 2.1 84.0 2.7 78.8 3.1 0.05 90.2 4.5 102 3.2 84.9 2.8 82.9 3.1 0.2 99.7 4.4 99.8 2.7 85.6 1.7 91.4 4.4 啶虫脒 0.01 82.0 3.0 84.0 2.1 78.4 1.6 82.8 2.1 0.05 87.0 1.7 94.3 3.1 94.3 1.1 92.5 3.1 0.2 88.7 1.4 94.0 2.5 94.0 2.0 99.7 1.7 咪唑乙烟酸 0.01 81.4 3.3 76.8 2.9 85.7 3.4 84.4 2.9 0.05 86.6 1.3 97.3 2.0 88.5 6.1 84.6 2.0 0.2 87.0 2.0 103 2.3 93.7 2.1 89.6 2.2 氟啶草酮 0.01 90.5 3.6 87.9 4.2 82.4 2.0 82.5 2.9 0.05 97.4 1.7 99.3 4.2 92.7 3.7 91.2 4.1 0.2 99.7 0.84 95.7 1.9 90.3 2.5 90.2 3.3 啶酰菌胺 0.01 81.1 6.9 88.8 6.4 78.3 2.0 77.1 6.8 0.05 87.8 5.6 96.2 2.0 93.1 2.7 89.6 2.6 0.2 84.1 4.4 96.1 1.8 93.6 2.0 91.9 1.1 噻唑烟酸 0.01 75.8 5.9 84.8 3.8 72.1 2.1 77.5 4.0 0.05 88.1 2.0 85.6 3.4 87.0 2.5 87.4 3.4 0.2 81.6 3.5 85.4 2.8 85.4 2.0 84.7 2.4 氟硫草定 0.01 74.6 4.5 84.9 4.4 76.0 2.5 74.5 6.3 0.05 80.9 2.1 86.7 1.5 86.7 4.1 85.9 2.3 0.2 78.4 2.3 85.9 2.5 90.4 5.2 91.2 3.2 由表3可知:本方法所得7种农药的回收率为74.6%~103%,测定值的RSD为0.84%~6.9%;标准方法所得7种农药的回收率为72.1%~99.7%,测定值的RSD为1.1%~6.8%,两种方法的准确度和精密度相当,均符合农药残留分析要求,说明本方法所用的QuEChERS有效,可以用于大米和小麦中吡啶类农药残留的日常检测。
2.4 样品分析
按照试验方法分析3份大米和3份小麦样品,均未检出7种农药。
本工作提出了QuEChERS净化,超高效液相色谱-串联质谱法测定大米和小麦中7种吡啶类农药含量的方法,该方法所得的线性范围、测定下限、回收率、RSD和GB 23200.50—2016的基本一致,说明将GB 23200.50—2016中的固相萃取法转换为QuEChERS是可行的。此外,QuEChERS具有前处理简单、快速等优点,适用于多批次大米和小麦中农药残留的检测。
-
表 1 质谱参数
Table 1 MS parameters
序号 农药 保留时间/min 母离子质荷比(m/z) 特征离子对m/z 碰撞能量/eV 1 吡虫啉 1.751 256.05 175.10*/209.05 17/14 2 啶虫脒 1.809 223.10 126.05*/56.10 22/15 3 咪唑乙烟酸 1.932 290.10 245.10*/177.05 19/26 4 氟啶草酮 2.445 330.05 309.05*/310.05 35/28 5 啶酰菌胺 2.563 343.00 307.10*/271.10 18/30 6 噻唑烟酸 2.850 397.20 376.90*/334.90 24/31 7 氟硫草定 3.022 402.00 354.10*/272.10 18/30 表 2 线性参数、ME值和测定下限
Table 2 Linearity parameters, ME values and lower limits of determination
农药 标准曲线类型 线性范围ρ/(μg·L−1) 线性回归方程 相关系数 ME值 测定下限w/(mg·kg−1) 吡虫啉 溶剂 1.0~50.0 y=6.285×103x−3.964×102 0.999 8 1.28 0.005 基质匹配 1.0~50.0 y=8.063×103x+3.698×102 0.999 9 啶虫脒 溶剂 1.0~50.0 y=3.482×104x+7.360×102 0.999 9 0.67 0.005 基质匹配 1.0~50.0 y=2.341×104x+1.390×103 0.999 9 咪唑乙烟酸 溶剂 1.0~50.0 y=2.636×104x−6.919×102 0.999 9 1.17 0.005 基质匹配 1.0~50.0 y=3.084×104x+1.478×103 0.999 5 氟啶草酮 溶剂 1.0~50.0 y=9.405×104x−5.239×102 0.999 4 1.06 0.005 基质匹配 1.0~50.0 y=9.946×104x−9.891×103 0.999 9 啶酰菌胺 溶剂 2.0~50.0 y=4.335×103x−2.198×102 0.999 9 1.13 0.010 基质匹配 2.0~50.0 y=4.892×103x−2.730 0.999 8 噻唑烟酸 溶剂 1.0~50.0 y=1.130×104x+3.282×102 0.999 9 1.29 0.005 基质匹配 1.0~50.0 y=1.462×104x−2.003×102 0.999 9 氟硫草定 溶剂 1.0~50.0 y=1.064×104x−6.371×102 0.999 8 0.89 0.005 基质匹配 1.0~50.0 y=9.421×103x+2.020×10 0.999 7 农药 加标量w/(mg·kg−1) 本方法 标准方法 大米 小麦 大米 小麦 回收率/% RSD/% 回收率/% RSD/% 回收率/% RSD /% 回收率/% RSD/% 吡虫啉 0.01 90.8 6.6 84.0 2.1 84.0 2.7 78.8 3.1 0.05 90.2 4.5 102 3.2 84.9 2.8 82.9 3.1 0.2 99.7 4.4 99.8 2.7 85.6 1.7 91.4 4.4 啶虫脒 0.01 82.0 3.0 84.0 2.1 78.4 1.6 82.8 2.1 0.05 87.0 1.7 94.3 3.1 94.3 1.1 92.5 3.1 0.2 88.7 1.4 94.0 2.5 94.0 2.0 99.7 1.7 咪唑乙烟酸 0.01 81.4 3.3 76.8 2.9 85.7 3.4 84.4 2.9 0.05 86.6 1.3 97.3 2.0 88.5 6.1 84.6 2.0 0.2 87.0 2.0 103 2.3 93.7 2.1 89.6 2.2 氟啶草酮 0.01 90.5 3.6 87.9 4.2 82.4 2.0 82.5 2.9 0.05 97.4 1.7 99.3 4.2 92.7 3.7 91.2 4.1 0.2 99.7 0.84 95.7 1.9 90.3 2.5 90.2 3.3 啶酰菌胺 0.01 81.1 6.9 88.8 6.4 78.3 2.0 77.1 6.8 0.05 87.8 5.6 96.2 2.0 93.1 2.7 89.6 2.6 0.2 84.1 4.4 96.1 1.8 93.6 2.0 91.9 1.1 噻唑烟酸 0.01 75.8 5.9 84.8 3.8 72.1 2.1 77.5 4.0 0.05 88.1 2.0 85.6 3.4 87.0 2.5 87.4 3.4 0.2 81.6 3.5 85.4 2.8 85.4 2.0 84.7 2.4 氟硫草定 0.01 74.6 4.5 84.9 4.4 76.0 2.5 74.5 6.3 0.05 80.9 2.1 86.7 1.5 86.7 4.1 85.9 2.3 0.2 78.4 2.3 85.9 2.5 90.4 5.2 91.2 3.2 -
[1] 谭海军,黄林,童益利,等. 吡啶类农用化学品品种及其合成[J]. 精细石油化工进展,2021,22(3):15-31. TAN H J ,HUANG L ,TONG Y L ,et al. Pyridine agrochemicals and their synthesis[J]. Advances in Fine Petrochemicals,2021,22(3):15-31.
[2] 王恒智,王立鹏,孙瑞红,等. 防治长柔毛野豌豆生草果园杂草茎叶处理剂筛选[J]. 果树学报,2022,39(4):674-684. WANG H Z ,WANG L P ,SUN R H ,et al. Screening of post-emergence herbicides to control weeds in Vicia villosa fields in orchards[J]. Journal of Fruit Science,2022,39(4):674-684.
[3] 张亮,吕海翔,石丹丹,等. 低剂量啶虫脒和双丙环虫酯对棉蚜茧蜂寄生功能的影响[J]. 农药学学报,2022,24(6):1417-1424. ZHANG L ,LÜ H X ,SHI D D ,et al. Effects of low doses of acetamiprid and afidopyropen on the parasitic function of Lysiphlebia japonica (Ashmead)[J]. Chinese Journal of Pesticide Science,2022,24(6):1417-1424.
[4] 朱琳,张蕊,张冰,等. 超高效液相色谱-串联质谱法快速测定大米中14种农药残留[J]. 中国粮油学报,2021,36(5):149-153. ZHU L ,ZHANG R ,ZHANG B ,et al. Rapid determination of 14 pesticide residues by UPLC-triple quadrupole tandem mass spectrometry[J]. Journal of the Chinese Cereals and Oils Association,2021,36(5):149-153.
[5] 邱世婷,侯雪,韩梅,等. 基质固相分散萃取-超高效液相色谱串联质谱法检测大米中27种农药残留量[J]. 食品安全质量检测学报,2020,11(13):4219-4225. QIU S T ,HOU X ,HAN M ,et al. Determination of 27 kinds of pesticides residues in rice by matrix solid phase dispersion extraction coupled with ultra performance liquid chromatography-tandem mass spectrometry[J]. Journal of Food Safety & Quality,2020,11(13):4219-4225.
[6] 张娟,汪杰,姚成虎. 分散固相萃取-气相色谱串联质谱法测定大米中的毒死蜱、三环唑和戊唑醇残留[J]. 农药,2018,57(11):823-825. ZHANG J ,WANG J ,YAO C H. Determination of chlorpyrifos,tricyclazole and tebuconazole residues in rice by gas chromatography-tandem mass spectrometry combined QuEChERS method[J]. Agrochemicals,2018,57(11):823-825.
[7] 李玮,贾彦博,林伟杰,等. 分散固相萃取净化-气相色谱-质谱联用法测定茶叶中7种杀螨杀虫类农药残留[J]. 食品安全质量检测学报,2017,8(9):3485-3490. LI W ,JIA Y B ,LIN W J ,et al. Determination of 7 pesticides residues in tea by gas chromatography-mass spectrometry combined with dispersive solid phase extraction[J]. Journal of Food Safety & Quality,2017,8(9):3485-3490.
[8] 张瑶,马桂娟,王紫昕,等. 气相色谱-质谱法结合固相萃取技术同时测定番茄中53种农药残留[J]. 食品科技,2021,46(1):292-297. ZHANG Y ,MA G J ,WANG Z X ,et al. Simultaneous determination of 53 pesticide residues in tomato by gas chromatography-mass spectrometry combined with solid phase extraction[J]. Food Science and Technology,2021,46(1):292-297.
[9] 赵光骞,雷国明,赵显正,等. 固相萃取-GC-MS/MS检测饮用水中常见的8种农残物[J]. 食品工业,2018,39(12):273-276. ZHAO G Q ,LEI G M ,ZHAO X Z ,et al. Determination of 8 pesticide residuals in water by SPE-GC-MS/MS method[J]. The Food Industry,2018,39(12):273-276.
[10] 虞游毅,杨璐,廖享,等. 固相微萃取-气相色谱质谱联用法测定苹果中4种有机氯类农药残留[J]. 农药,2018,57(1):54-57. YU Y Y ,YANG L ,LIAO X ,et al. Determination of four organochlorine pesticide residues in apple by solid phase microextraction coupled with gas chromatography-mass spectrometry[J]. Agrochemicals,2018,57(1):54-57.
[11] 谢敏,赵立军,周瑶敏,等. QuEChERS-超高效液相色谱-串联质谱测定青贮牧草中23种农药残留[J]. 分析试验室,2023,42(2):203-208. XIE M ,ZHAO L J ,ZHOU Y M ,et al. Simultaneous determination of 23 pesticides residues in silage forage grass by QuEChERS-based ultra-high performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Analysis Laboratory,2023,42(2):203-208.
[12] 张盈,魏进,龙家寰,等. QuEChERS-超高效液相色谱-串联质谱法同时检测辣椒中6种农药残留[J]. 农药,2022,61(3):198-202. ZHANG Y ,WEI J ,LONG J H ,et al. QuEChERS-UHPLC-MS/MS method for simultaneous determination of 6 pesticide residues in pepper[J]. Agrochemicals,2022,61(3):198-202.
[13] 国家卫生和计划生育委员会,农业部,国家食品药品监督管理总局食品安全国家标准 食品中吡啶类农药残留量的测定 液相色谱-质谱/质谱法:GB 23200.50—2016北京中国标准出版社2017国家卫生和计划生育委员会,农业部,国家食品药品监督管理总局. 食品安全国家标准 食品中吡啶类农药残留量的测定 液相色谱-质谱/质谱法:GB 23200.50—2016[S]. 北京:中国标准出版社,2017. State Family Planning Commission of the People's Republic of China,Ministry of Agriculture of the People's Republic of China,State Food and Drug AdministrationNational food safety standards—Determination of pyridine pesticides residue in foods —Liquid chromatography-mass spectrometry:GB 23200.50—2016BeijingStandards Press of China2017State Family Planning Commission of the People's Republic of China,Ministry of Agriculture of the People's Republic of China,State Food and Drug Administration. National food safety standards—Determination of pyridine pesticides residue in foods —Liquid chromatography-mass spectrometry:GB 23200.50—2016[S]. Beijing:Standards Press of China,2017.
[14] 魏进,张盈,王洪瑶,等. QuEChERS-超高效液相色谱-串联质谱法同时检测大米中5种农药残留[J]. 食品安全质量检测学报,2021,12(5):1783-1788. WEI J ,ZHANG Y ,WANG H Y ,et al. Simultaneous determination of 5 kinds of pesticide residues in rice by QuEChERS-ultra performance liquid chromatography-tandem mass spectrometry[J]. Journal of Food Safety & Quality,2021,12(5):1783-1788.
[15] 穆应花,邢家溧,沈坚,等. QuEChERS-气相色谱-质谱法检测鱼肉中19种氯酚类化合物[J]. 色谱,2022,40(5):477-487. MU Y H ,XING J L ,SHEN J ,et al. Determination of 19 chlorophenols in fish by QuEChERS-gas chromatography-mass spectrometry[J]. Chinese Journal of Chromatography,2022,40(5):477-487.



 下载:
下载: