Determination of Azodicarbonamide in Flour by Visual Colorimetry
-
摘要:
基于偏钒酸铵在磷酸介质中对偶氮二甲酰胺(ADA)氧化靛蓝二磺酸钠褪色反应的催化作用,提出了可视化比色法测定面粉中ADA含量的方法。在试管中依次加入150 mg·L−1偏钒酸铵溶液1.0 mL、0.001 mol·L−1 靛蓝二磺酸钠溶液1.1 mL、85%(体积分数)磷酸溶液3.0 mL和样品溶液4.5 mL,于45 ℃反应35 min。以水为参比,测量溶液在610 nm处的吸光度A;用手机拍摄图片,通过智能手机中的颜色识别器应用程序提取图片的RGB值(红、绿、蓝值)。结果显示:ADA的质量浓度在40.0 mg·L−1以内与吸光度A或R/B值(红、蓝值之比)呈线性关系,检出限(3s/k)分别为0.015,4.518 mg·L−1;对空白样品进行加标回收试验,ADA的回收率为94.0%~114%,测定值的相对标准偏差(n=5)为2.3%~6.8%。
Abstract:A method for the determination of azodicarbonamide (ADA) in flour by visual colorimetry was proposed based on the catalytic effect of ammonium metavanadate in phosphoric acid medium on the discoloration reaction of sodium indigo disulfonate oxidized by ADA. 1.0 mL of 150 mg·L−1 ammonium metavanadate solution, 1.1 mL of 0.001 mol·L−1 sodium indigo disulfonate solution, 3.0 mL of 85% (volume fraction) phosphoric acid solution and 4.5 mL of sample solution were added in the tube, and the reaction was carried out at 45 ℃ for 35 min. Using water as reference, the absorbance A of the solution at 610 nm was measured. The picture was taken by phone and the RGB value of the picture was extracted through the application program of color recognizer in smartphone. As shown by the results, linear relationships between the mass concentration of ADA and absorbance A or R/B value were kept within 40.0 mg·L−1, with detection limits (3s/k) of 0.015, 4.518 mg·L−1, respectively. Test for recovery was made on the blank sample by standard addition method, giving results in the range of 94.0%-114%, with RSDs (n=5) of the determined values in the range of 2.3%-6.8%.
-
Keywords:
- azodicarbonamide /
- sodium indigo disulfonate /
- visual colorimetry /
- absorbance /
- smartphone
-
偶氮二甲酰胺(ADA)是一种淡黄色或白色粉末,具有很强的极性,易溶于N,N-二甲基甲酰胺和二甲基亚砜(DMSO),微溶于丙酮。ADA可应用于塑料的发泡剂和纺织工艺的发泡印花工艺,也是谷物面粉中的成熟剂和漂白剂,还具有潜在的药用价值[1]。但是,ADA会破坏面粉中的维生素,经过湿热处理后作为面粉蛋白的氧化剂,会转化为联二脲(BIU)和氨基脲(SEM)。而SEM是兽药呋喃西林的代谢物,对哺乳动物有很大危害,具有较强的致癌、致畸、致突变作用,对人体的多个组织器官都具有毒性,甚至会影响神经系统和分泌系统的运作[2-3]。因此,世界卫生组织曾建议要尽可能减少ADA的摄入量[4]。近年来,欧盟、新西兰、新加坡和日本等地区和国家明确禁止在食品中添加ADA,欧洲化学品管理局颁布的相关法规限制ADA作为发泡剂在各类合成材料中使用,国际纺织及皮革生态学研究和检测协会要求ADA类物质的限量值应小于1 000 mg·kg−1[5]。
目前检测ADA的方法主要分为直接检测法和间接检测法[6]。直接检测法包括表面增强拉曼光谱法[7]、近红外光谱法[8]、毛细管电泳法[9]和高效液相色谱法[10]等;间接检测法则是测定由ADA转化而来的BIU和SEM等一些分解产物,包括酶联免疫吸附法和液相色谱-质谱联用法[11-14]。虽然这些方法具有良好的准确度和灵敏度,但是所需仪器昂贵、操作步骤复杂、预处理耗时长,严重限制了它们的广泛应用,尤其是在资源有限的现场监测情况下,开发便携的ADA实时检测方法非常关键[15],而现场可视化比色法是目前的研究热点[16]。鉴于此,本工作利用偏钒酸铵在磷酸介质中对ADA氧化靛蓝二磺酸钠反应的催化作用,采用分光光度法测定溶液吸光度,并利用智能手机识别溶液的RGB值(红、绿、蓝值),以实现对ADA的定量检测(见图1)。
1. 试验部分
1.1 仪器与试剂
VIS-7220N型可见分光光度计;ZHWY-200B型全温度恒温培养振荡器。
偏钒酸铵溶液:称取0.015 0 g偏钒酸铵于100 mL烧杯中,加入0.032 4 g草酸和少量水,搅拌使其溶解,再将溶液转移至100 mL容量瓶中,用水稀释至刻度,配制成质量浓度为150 mg·L−1的偏钒酸铵溶液,室温保存备用。
靛蓝二磺酸钠溶液:称取0.466 0 g靛蓝二磺酸钠,用水溶解并稀释至100 mL,配制成0.01 mol·L−1靛蓝二磺酸钠溶液;分取5.0 mL,用水稀释至50 mL,配制成0.001 mol·L−1靛蓝二磺酸钠溶液。
ADA标准储备溶液:称取0.025 0 g ADA于25 mL烧杯中,用少量DMSO溶解后,转移至25 mL容量瓶中,用水稀释至刻度,配制成1 000 mg·L−1 ADA标准储备溶液。
ADA标准溶液系列:取适量的1 000 mg·L−1 ADA标准储备溶液,用水稀释至50 mL,配制成质量浓度为0,1.0,5.0,10.0,20.0,30.0,40.0 mg·L−1的ADA标准溶液系列。
试验所用试剂均为分析纯;试验用水为蒸馏水。
1.2 试验方法
1.2.1 ADA标准曲线建立
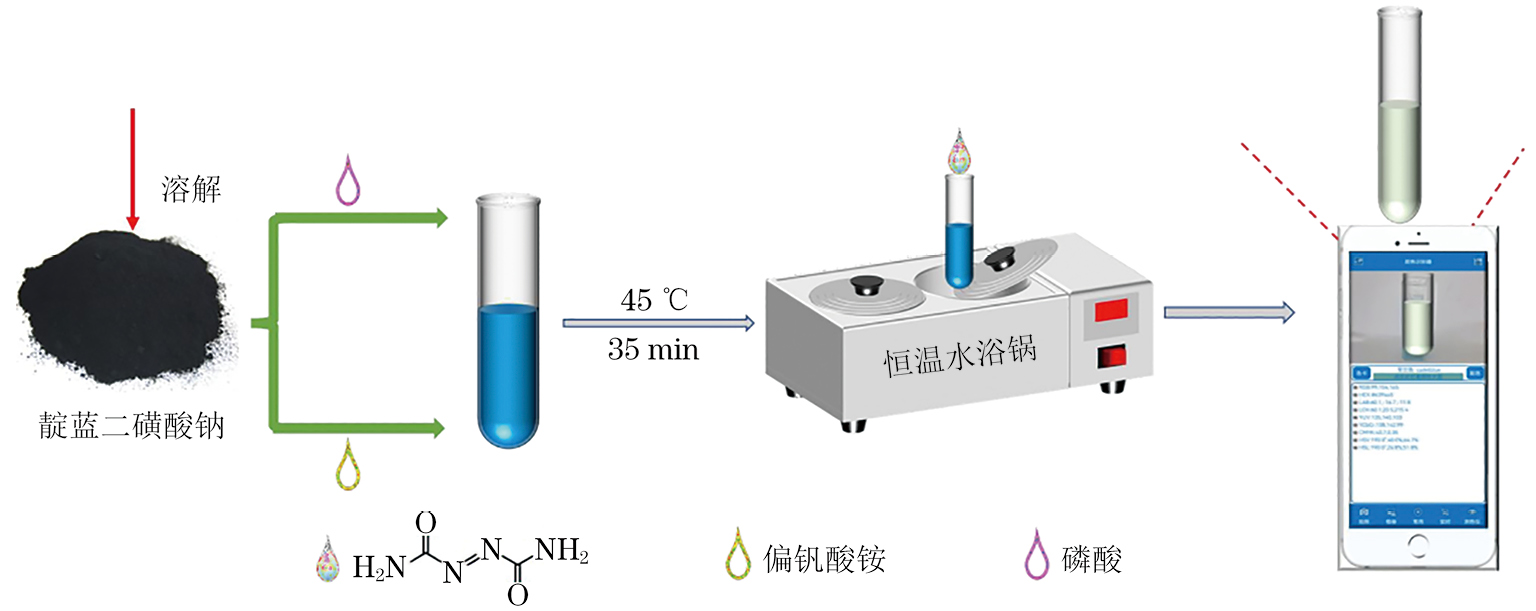
在试管中依次加入150 mg·L−1偏钒酸铵溶液1.0 mL、0.001 mol·L−1靛蓝二磺酸钠溶液1.1 mL,ADA标准溶液系列4.5 mL和85%(体积分数)磷酸溶液3.0 mL,摇匀,于45 ℃恒温水浴加热条件下反应35 min。以水为参比,测定溶液在610 nm处[17]的吸光度A。用手机拍摄图片,通过智能手机中的颜色识别器应用程序提取图片的RGB值。以ADA的质量浓度为横坐标,对应的吸光度A或R/B值(红、蓝值之比)为纵坐标绘制标准曲线。
1.2.2 样品前处理
取0.800 0 g面粉于250 mL锥形瓶中,加入5 mL DMSO和15 mL水,封口放置在振荡器中,在室温下以转速200 r·min−1振荡15 min,静置5 min。将溶液转移至10 mL离心管中,以转速4 000 r·min−1离心10 min,取上清液,加入0.200 0 g活性炭,搅拌均匀后静置吸附20 min,用布氏漏斗抽滤,滤液经0.45 μm有机相滤膜过滤。滤液用水稀释至100 mL,备用。按照1.2.1节方法测量吸光度A和提取RGB值。
1.3 试验原理
靛蓝二磺酸钠是一种氧化还原指示剂,其还原态为无色,氧化态呈蓝色,氧化态可被氧化剂进一步氧化分解为无色靛红及其衍生物。ADA为氧化剂,但直接氧化有机物的速率很慢,基于偏钒酸铵在酸性条件下对ADA氧化靛蓝二磺酸钠的催化作用,将靛蓝二磺酸钠氧化,溶液颜色从蓝色褪至无色[18]。利用智能手机中的颜色识别器应用程序,通过识别溶液的RGB值,建立ADA质量浓度与吸光度A或R/B值的线性关系[19]。
2. 结果与讨论
2.1 靛蓝二磺酸钠溶液加入量的选择
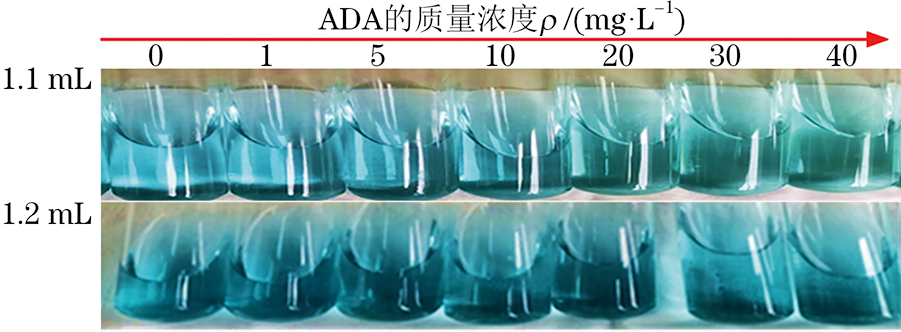
试验考察了0.001 mol·L−1靛蓝二磺酸钠溶液加入量为0.8~1.5 mL时对以吸光度A为纵坐标建立的ADA标准曲线相关系数的影响。结果显示:当靛蓝二磺酸钠溶液加入量分别为0.8,1.0,1.1,1.2,1.4,1.5 mL时,相关系数分别为0.781 0,0.919 8,0.988 9,0.993 0,0.966 4,0.933 8,其中加入1.1,1.2 mL靛蓝二磺酸钠溶液的线性关系较好,并且通过观察溶液颜色(图2)发现,加入1.1 mL靛蓝二磺酸钠溶液时,随着ADA质量浓度的增大,溶液颜色由蓝色逐渐变成绿色,而加入1.2 mL靛蓝二磺酸钠溶液时,溶液始终呈蓝色。因此,试验选择的靛蓝二磺酸钠溶液的加入量为1.1 mL。
2.2 偏钒酸铵溶液加入量的选择
试验考察了偏钒酸铵溶液的加入量对以吸光度A为纵坐标建立的ADA标准曲线相关系数的影响。结果显示:当加入1.0 mL 150 mg·L−1偏钒酸铵溶液时,相关系数为0.993 5;当加入20 μL 偏钒酸铵饱和溶液时,相关系数为0.976 7。可以发现加入1.0 mL 150 mg·L−1偏钒酸铵溶液的线性关系较好,且通过进一步试验观察,该溶液颜色变化梯度最明显,有利于RGB值的提取和肉眼观察溶液颜色的变化。因此,试验选择加入1.0 mL 150 mg·L−1偏钒酸铵溶液。
2.3 反应温度的选择
试验考察了反应温度(25,35,45,55,65 °C)对以吸光度A为纵坐标建立的ADA标准曲线相关系数的影响。结果显示:当反应温度为25,35,45,55,65 °C时,相关系数为0.993 0,0.979 8,0995 5,0.997 5,0.974 7,其中45 ℃和55 °C时相关系数均在0.990 0以上,并且通过颜色观察,45 °C时的颜色梯度变化最明显。因此,试验选择的反应温度为45 °C。
2.4 反应时间的选择
试验考察了反应时间(25,35,45 min)对以吸光度A为纵坐标建立的ADA标准曲线相关系数的影响。结果显示,当反应时间为25,35,45 min时,相关系数为0.996 0,0.995 0,0.996 0,3个反应时间下均可得到良好的线性关系,而25 min时颜色梯度变化相对其他反应时间不是很明显。综合考虑,试验选择的反应时间为35 min。
2.5 特异性试验
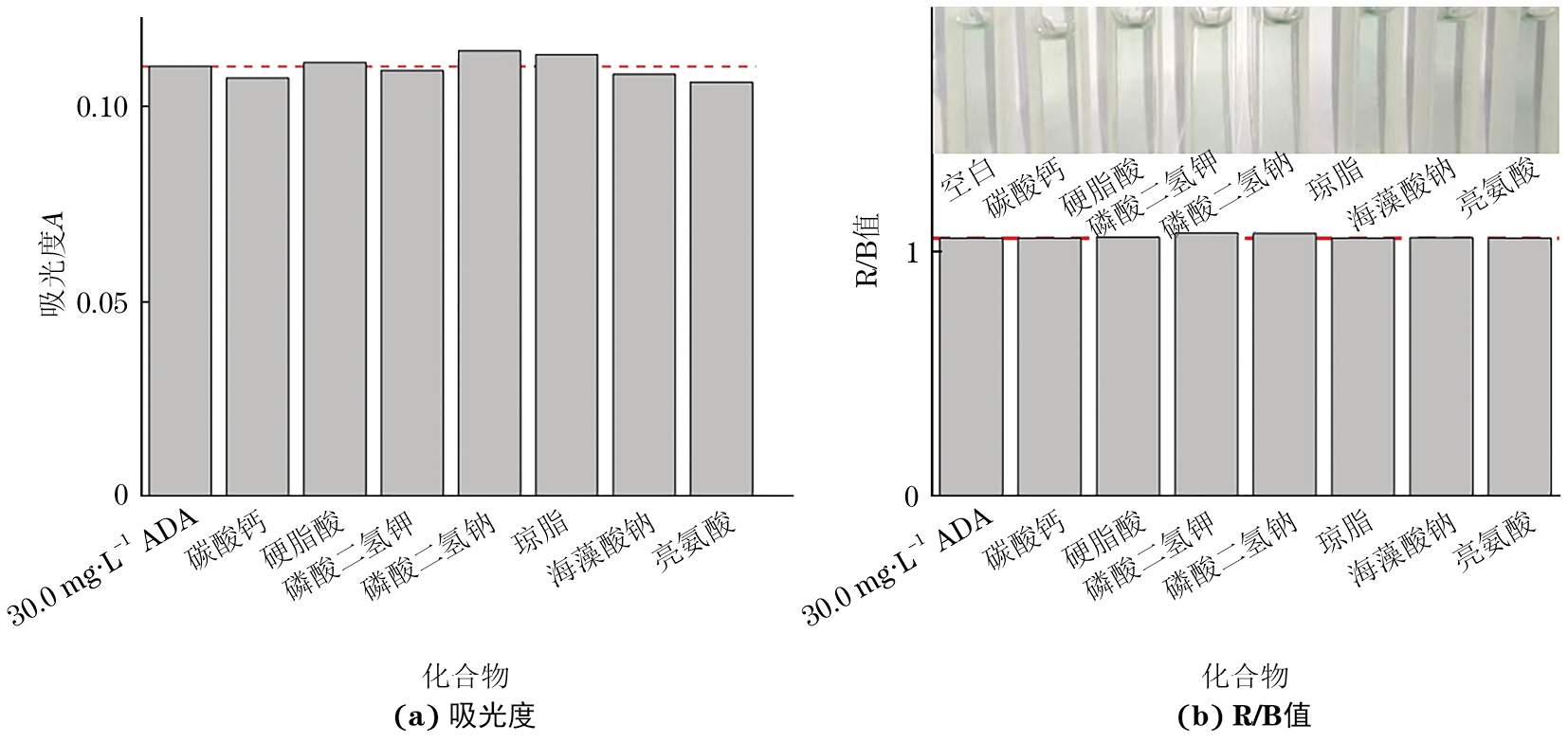
选择面粉中一些潜在的干扰物质,如碳酸钙、硬脂酸、磷酸二氢钾、磷酸二氢钠、琼脂、海藻酸钠、亮氨酸等进行试验。对于易溶于水的干扰物质,配制成浓度为0.1 mol·L−1的溶液;对于难溶于水的干扰物质,配制成饱和溶液。在ADA质量浓度为30.0 mg·L−1的检测溶液中分别加入20 μL干扰物质溶液,每种干扰物质平行做3组,吸光度A和R/B值结果如图3所示。
由图3可知,与30.0 mg·L−1 ADA的检测溶液比较,加入20 μL干扰物质溶液的吸光度A的变化幅度为-0.004~0.004,R/B值的变化幅度在0.022以内,相对误差的绝对值不超过5.0%,表明这些潜在干扰物质对ADA检测影响较小或没有干扰,该方法具有良好的特异性。
2.6 标准曲线与检出限
按照1.2.1节试验方法绘制标准曲线。分光光度法和智能手机成像法得到的ADA标准曲线的线性范围、线性回归方程和相关系数见表1。
表 1 线性参数和检出限Table 1. Linearity parameters and detection limits方法 线性范围ρ/(mg·L−1) 线性回归方程 相关系数 检出限ρ/(mg·L−1) 分光光度法 40.0以内 y=-8.230×10−3x+3.498×10−1 0.996 5 0.015 智能手机成像法 40.0以内 y=1.436×10−2x+6.104×10−1 0.995 6 4.518 以3s/k(s表示空白溶液3次测定值的标准偏差,k表示线性回归方程的斜率)计算检出限[20],结果见表1。
2.7 精密度和回收试验
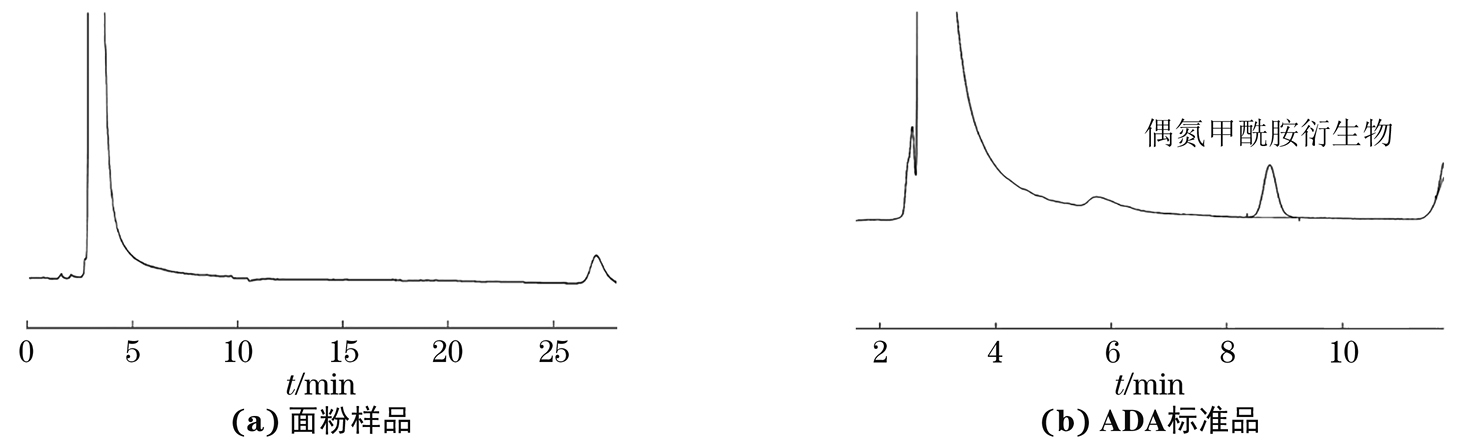
按照GB 5009.283-2021《食品安全国家标准食品中偶氮甲酰胺的测定》对面粉样品中ADA进行检测[图4(a)],并与ADA标准品色谱图[图4(b)]进行比较,结果显示该样品中不含ADA。按照1.2节试验方法进行分析,结果同样表明该样品中不含ADA。
在50 mL面粉样品处理溶液中加入一定量的ADA标准溶液,使其质量浓度为5.0,20.0,30.0 mg·L−1,按照1.2.1节方法进行测定,计算回收率和测定值的相对标准偏差(RSD),结果见表2。
加标量ρ/(mg·L−1) 分光光度法 智能手机成像法 回收率/% RSD/% 回收率/% RSD/% 5.0 114 6.8 94.0 2.8 20.0 102 2.3 110 4.9 30.0 104 6.0 107 6.4 由表2可知,ADA的回收率为94.0%~114%,测定值的RSD为2.3%~6.8%,表明两种定量方法均具有良好的准确度和精密度。
本工作采用分光光度法和智能手机成像功能,提出了可视化比色法测定面粉中ADA含量的方法,该方法特异性好、准确度高,可用于实际样品分析。
-
表 1 线性参数和检出限
Table 1 Linearity parameters and detection limits
方法 线性范围ρ/(mg·L−1) 线性回归方程 相关系数 检出限ρ/(mg·L−1) 分光光度法 40.0以内 y=-8.230×10−3x+3.498×10−1 0.996 5 0.015 智能手机成像法 40.0以内 y=1.436×10−2x+6.104×10−1 0.995 6 4.518 加标量ρ/(mg·L−1) 分光光度法 智能手机成像法 回收率/% RSD/% 回收率/% RSD/% 5.0 114 6.8 94.0 2.8 20.0 102 2.3 110 4.9 30.0 104 6.0 107 6.4 -
[1] 吴桂安金属-有机骨架材料(MOF)及MOF/偶氮二甲酰胺复合物的制备北京北京化工大学2010吴桂安. 金属-有机骨架材料(MOF)及MOF/偶氮二甲酰胺复合物的制备[D]. 北京: 北京化工大学, 2010. [2] CHOI K Y, LIM H H, SHIN H S. Development of a simultaneous analysis method of azodicarbonamide, semicarbazide, and hydrazine in flour products using HPLC[J]. Bulletin of the Korean Chemical Society, 2022, 43(4):585-594. [3] ZHU Y D, HANG Y P, HUANG X S, et al. Sensitive determination of semicarbazide in flour by differential pulse voltammetry[J]. Journal of Analytical Chemistry, 2019, 74(9):913-919. [4] NORMAND J C, GRANGE F, HERNANDEZ C, et al. Occupational asthma after exposure to azodicarbonamide: Report of four cases[J]. British Journal of Industrial Medicine, 1989, 46(1):60-62. [5] 宗丽华. OEKO-TEX® Standard100 检验标准: 2015年新规定[J]. 染料与染色, 2015, 52(1):62-62. [6] CHEN Z Q, CHEN L A, LIN L, et al. A colorimetric sensor for the visual detection of azodicarbonamide in flour based on azodicarbonamide-induced anti-aggregation of gold nanoparticles[J]. ACS Sensors, 2018, 3(10):2145-2151. [7] WU Y P, YU W F, YANG B H, et al. Self-assembled two-dimensional gold nanoparticle film for sensitive nontargeted analysis of food additives with surface-enhanced Raman spectroscopy[J]. Analyst, 2018, 143(10):2363-2368. [8] CHE W K, SUN L J, ZHANG Q A, et al. Application of visible/near-infrared spectroscopy in the prediction of azodicarbonamide in wheat flour[J]. Journal of Food Science, 2017, 82(10):2516-2525. [9] CHEN L, CUI H, DONG Y L, et al. Simultaneous detection of azodicarbonamide and the metabolic product semicarbazide in flour by capillary electrophoresis[J]. Food Analytical Methods, 2016, 9(5):1106-1111. [10] 李成发, 王成云, 林君峰, 等. 高效液相色谱法测定纺织品中的偶氮二甲酰胺质量浓度[J]. 染整技术, 2022, 44(3):46-51. [11] LI G L, TANG C H, WANG Y, et al. A rapid and sensitive method for semicarbazide screening in foodstuffs by HPLC with fluorescence detection[J]. Food Analytical Methods, 2015, 8(7):1804-1811. [12] YU W L, LIU M X, LIU R B, et al. Development of biomimetic enzyme-linked immunosorbent assay based on molecular imprinting technique for semicarbazide detection[J]. Food and Agricultural Immunology, 2020, 31(1):17-32. [13] MULDER P P J, BEUMER B, VAN RHIJN J A. The determination of biurea: A novel method to discriminate between nitrofurazone and azodicarbonamide use in food products[J]. Analytica Chimica Acta, 2007, 586(1/2):366-373. [14] WEI T F, LI G K, ZHANG Z M. Rapid determination of trace semicarbazide in flour products by high-performance liquid chromatography based on a nucleophilic substitution reaction[J]. Journal of Separation Science, 2017, 40(9):1993-2001. [15] ZHANG L W, XIN F L, CAI Z X, et al. A colorimetric sensing platform for azodicarbonamide detection in flour based on MnO2 nanosheets oxidative system[J]. Analytical and Bioanalytical Chemistry, 2021, 413(19):4887-4894. [16] JEBER J N, HASSAN R F, HAMMOOD M K, et al. Sensitive and simple colorimetric methods for visual detection and quantitative determination of semicarbazide in flour products using colorimetric reagents[J]. Sensors and Actuators B: Chemical, 2021, 341:130009. [17] 郭妍, 贺心然, 肖晶, 等. 靛蓝二磺酸钠分光光度法测定水中总氮[J]. 淮海工学院学报(自然科学版), 2013, 22(2):64-67. [18] 白林山, 张金华, 张世欢. 靛蓝二磺酸钠-溴酸钾体系催化光度法测定钢铁中微量钒[J]. 光谱学与光谱分析, 2002, 22(1):120-122. [19] LIU T, CHEN S R, RUAN K, et al. A handheld multifunctional smartphone platform integrated with 3D printing portable device: On-site evaluation for glutathione and azodicarbonamide with machine learning[J]. Journal of Hazardous Materials, 2022, 426:128091. [20] WANG H Q, DA L G, YANG L, et al. Colorimetric fluorescent paper strip with smartphone platform for quantitative detection of cadmium ions in real samples[J]. Journal of Hazardous Materials, 2020, 392:122506.



 下载:
下载: