Determination of 8 Bisphenol Compounds in Source Water in Guangdong Province by High Performance Liquid Chromatography-Tandem Mass Spectrometry with Polyamide Solid Phase Extraction
-
摘要:
提出了聚酰胺固相萃取结合高效液相色谱-串联质谱法(HPLC-MS/MS)测定广东省水源水中双酚A、双酚AP、双酚B、双酚AF、双酚F、双酚E、双酚Z和双酚C等8种双酚类化合物的含量。取500 mL水样过填装1.00 g聚酰胺的固相萃取柱,用6 mL甲醇洗脱,取1 mL洗脱液过0.22 µm尼龙针式过滤器,采用HPLC-MS/MS测定其中8种双酚类化合物的含量,以Acquity UPLC BEH C18色谱柱为固定相,以不同体积比的0.1 mmol·L-1碳酸氢铵溶液-甲醇混合液为流动相进行梯度洗脱,基质匹配法定量。结果表明,双酚类化合物的质量浓度在一定范围内与对应的峰面积呈线性关系,检出限(3S/N)为0.12~10.50 ng·L-1。按照标准加入法进行回收试验,回收率为73.3%~111%,测定值的相对标准偏差(n=5)为1.4%~12%。方法用于从广东省11个城市采集的14份自来水、11份江河水、3份山泉水、2份水库水、2份湖水和1份井水样品的分析,结果显示8种双酚化合物的检出率为3.03%~87.88%,平均质量浓度为0.18~290.22 ng·L-1,平均质量浓度总和为327.48 ng·L-1。
-
关键词:
- 高效液相色谱-串联质谱法(HPLC-MS/MS) /
- 水样 /
- 双酚类化合物 /
- 聚酰胺
Abstract:A method for determination of 8 bisphenol compounds, including bisphenol A, bisphenol AP, bisphenol B, bisphenol AF, bisphenol F, bisphenol E, bisphenol Z, and bisphenol C, in source water from Guangdong Province was proposed by high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS) with polyamide solid phase extraction. The water sample (500 mL) was passed through a solid phase extraction column packed with 1.00 g of polyamide, followed by elution with 6 mL of methanol. The eluent (1 mL) was filtered through a 0.22 µm-nylon needle filter, and the 8 bisphenol compounds were determined by HPLC-MS/MS using Acquity UPLC BEH C18 column as the stationary phase and a mixed solution composed of 0.1 mmol·L−1 ammonium bicarbonate aqueous solution and methanol at different volume ratios as the mobile phase for gradient elution, with quantitative analysis by matrix matching method. As shown by the results, linear relationships between the corresponding peak areas and mass concentrations of the bisphenol compounds were kept in definite ranges, with detection limits (3S/N) in the range of 0.12-10.50 ng·L−1. Test for recovery was made by the standard addition method, giving results in the range of 73.3%-111%, and RSDs (n=5) of the determined values ranged from 1.4% to 12%. This method was applied to the analysis of 14 tap water samples, 11 river water samples, 3 spring water samples, 2 reservoir water samples, 2 lake water samples, and 1 well water sample collected from 11 cities in Guangdong Province. It was shown that the detection rates of the 8 bisphenol compounds ranged from 3.03% to 87.88%, with average mass concentrations in the range of 0.18-290.22 ng·L−1 and the total average mass concentration of 327.48 ng · L−1.
-
双酚类化合物(BPs)作为重要的有机化工原料,广泛应用于塑料瓶、食品接触涂层、管道、玩具、医疗设备和电子产品等的制造[1-2]。但BPs具有内分泌干扰作用,对动物的生长发育、生殖、免疫、神经以及代谢存在毒性效应[1]。BPs通过工业制造过程排放、受污染土壤经雨水径流冲刷溶出等途径进入水环境,研究发现,水环境样品中BPs含量较低,不同来源BPs的含量差异较大,且水样中共存物质会对样品检测产生较大干扰[3-4]。因此,有必要建立准确、灵敏、高效的分析方法测定环境水体中BPs的含量。
样品前处理是分析过程的重要环节,集提取、分离、浓缩于一体的固相萃取法是大体积水样中痕量BPs检测的常用方法[4],二乙烯基苯/N-乙烯基吡咯烷酮共聚物(HLB)[3,5-6]、十八烷基硅烷键合硅胶(C18)[7]、碳纳米材料[8-9]和分子印迹材料[4,10]是水体中BPs检测的常见固相萃取吸附剂。但以上吸附剂价格昂贵、制备繁琐,在一定程度上增加了分析成本。聚酰胺作为廉价、高效的吸附材料常用于水体中重金属[11]、合成色素[12]、抗生素[13]、酚类物质[14]的吸附。文献[15]研究发现,聚酰胺粉末对双酚F(BPF)、双酚A(BPA)、双酚B(BPB)和双酚AP(BPAP)的吸附容量为170~210 μg·g-1。本工作以聚酰胺作为固相萃取柱填料用于水中BPs的吸附萃取,结合灵敏度高、检测通量高和抗干扰性强的高效液相色谱-串联质谱法(HPLC-MS/MS),实现了大体积水样中BPA、BPAP、BPB、双酚AF(BPAF)、BPF、双酚E(BPE)、双酚Z(BPZ)和双酚C(BPC)等8种痕量BPs的残留分析。目前,广东省水源水中BPs的研究调查主要集中在珠江流域[16],较少涉及自来水、水库水、井水/山泉水等其他给水水源。因此,本工作在广东省11个城市采集6种水源水样,并对其中的8种BPs的含量进行监测,分析其污染现状,为饮用水健康风险评价提供基础数据。
1. 试验部分
1.1 仪器与试剂
Waters Xevo TQD型液相色谱-质谱联用仪;LC-SPE-12型固相萃取仪;LC-LX-H165A型高速离心机;YP2001B型电子天平;Milli-Q100型纯水仪;30 mL固相萃取空柱;定量滤纸;有机尼龙66 (nylon)针式过滤器;聚醚砜(PES)针式过滤器和聚偏二氟乙烯(PVDF)针式过滤器(直径13 mm,孔径0.22 µm);聚四氟乙烯(PTFE)针式过滤器(直径13 mm,孔径0.45 µm)。
混合标准储备溶液:1 000 mg·L-1,分别称取8种BPs标准品各10 mg,用少量乙腈溶解,转移到10 mL容量瓶中,用乙腈定容,再转移至20 mL棕色储液瓶中,于-18 ℃冰箱中保存。使用时,用甲醇稀释至所需质量浓度。同法制备单标准储备溶液。
0.1 mmol·L-1碳酸氢铵溶液:准确称取7.9 mg碳酸氢铵置于1 L流动相瓶中,加入1 L蒸馏水溶解,再加入1 mL甲醇,过0.22 μm水系滤膜后超声10 min,备用。
8种BPs标准品的纯度均不小于99%;甲醇、乙腈和碳酸氢铵均为色谱纯;聚酰胺(100~200目,即粒径为0.075~0.15 mm);试验用水为超纯水。
1.2 仪器工作条件
1.2.1 色谱条件
Acquity UPLC BEH C18色谱柱(50 mm×2.1 mm,1.7 µm);柱温 25 ℃;进样量 5 µL;流量0.2 mL·min-1;流动相 A为0.1 mmol·L-1碳酸氢铵溶液,B为甲醇。梯度洗脱程序:0~1.0 min,B为40%;1.0~6.5 min,B由40%升至95%;6.5~7.0 min,B由95%降至40%,保持2.0 min。
1.2.2 质谱条件
电喷雾离子(ESI)源,负离子(ESI-)模式;离子源温度150 ℃;毛细管电压3.0 kV;脱溶剂气温度500 ℃;脱溶剂气流量1 000 L·h-1;多反应监测(MRM)模式,离子对采集时间段 3~8 min。其他质谱参数见表1,其中“*”代表定量离子。
表 1 质谱参数Table 1. MS parameters化合物 保留时间/min 母离子质荷比(m/z) 子离子m/z 去簇电压/V 碰撞能量/eV BPF 3.30 199.05 92.97*,199.55 54 22,20 BPE 4.13 213.06 197.96*,118.99 50 18,26 BPA 4.68 227.07 212.04*,132.98 46 18,26 BPB 5.30 241.07 212.00*,226.05 50 18,18 BPAF 5.63 335.02 265.01*,197.03 48 22,38 BPAP 5.65 289.10 274.03*,195.07 54 22,24 BPC 5.68 255.08 240.01*,147.03 58 20,28 BPZ 5.94 267.12 173.03*,223.17 66 26,32 1.3 试验方法
水样经定量滤纸过滤。称取1.00 g聚酰胺于固相萃取空柱中,上下装上筛板。将500 mL过滤后的水样过柱,控制液体流量为1滴·s-1,待水样全部流出固相萃取柱,抽滤30 min。再加入6 mL甲醇洗脱,收集洗脱液,取1 mL洗脱液经0.22 µm nylon针式过滤器过滤至进样小瓶,按照仪器工作条件测定。
2. 结果与讨论
2.1 流动相的选择
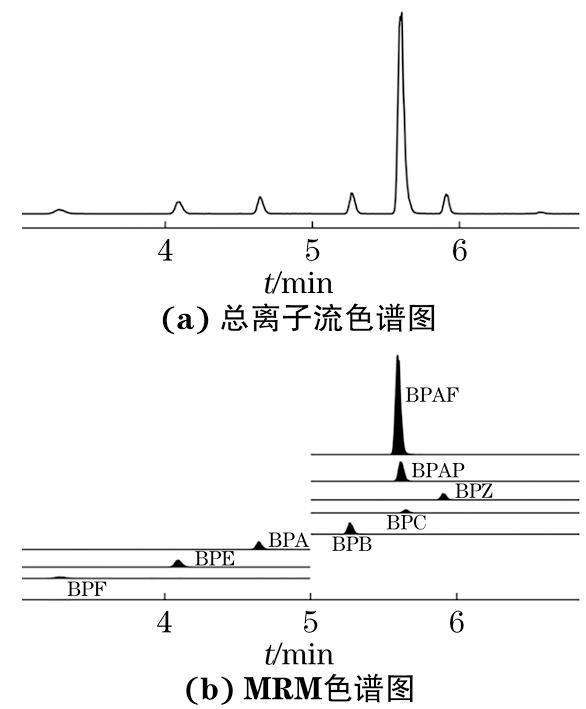
试验固定0.1 mmol·L-1碳酸氢铵溶液为水相,选择甲醇和乙腈作为有机相进行优化。结果显示:使用乙腈作为有机相时,BPs峰形较差,均出现拖尾现象;使用甲醇作为有机相时,BPs峰形较好,响应值较高。因此,试验选择0.1 mmol·L-1碳酸氢铵溶液-甲醇体系作为流动相。在优化的色谱条件下,0.1 mg·L-1混合标准溶液的总离子流色谱图和MRM色谱图见图1。
2.2 针式过滤器材质的选择
试验用甲醇稀释混合标准储备溶液,配制0.1 mg·L-1的混合标准溶液,分别经材质为PVDF、PES、PTFE、nylon的针式过滤器过滤,测定BPs峰面积,并计算回收率。结果显示:nylon对8种BPs的吸附作用最小,经nylon针式过滤器过滤后,8种BPs的回收率为77.1%~108%;PVDF、PES、PTFE都对BPs有不同程度的吸附作用,经PVDF针式过滤器过滤后,BPB和BPE的回收率分别为62.1%和66.8%,经PTFE针式过滤器过滤后,BPE和BPF的回收率分别为61.8%和48.4%,经PES针式过滤器过滤后,BPB、BPA、BPE和BPF的回收率分别为68.6%,62.6%,43.1%和48.2%。综合考虑,试验最终选择材质为nylon的针式过滤器进行过滤。
2.3 上样体积的选择
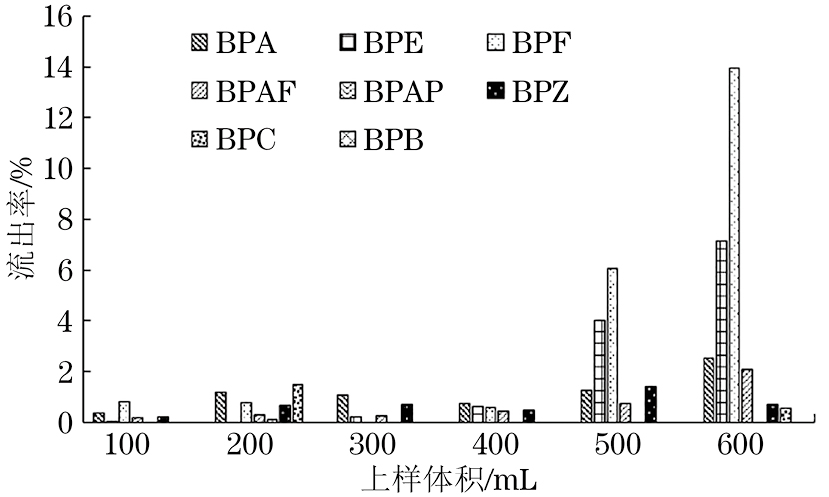
为确定聚酰胺用量为1.00 g的条件下含BPs水样的最大上样体积,试验分别将100,200,300,400,500,600 mL的0.02 mg·L-1混合BPs水样进行上样操作,取1 mL流出液在10 000 r·min-1的转速下离心2 min,取上清液用等体积甲醇稀释,按照仪器工作条件测定。获得BPs峰面积数据后,按照A1/A2×100%[A1为经甲醇等体积稀释后的流出液中单BPs的峰面积,A2为对应的0.01 mg·L-1 BPs单标准溶液(用体积比1∶1的甲醇-水混合液配制)中单BPs的峰面积]计算BPs在上样过程中的流出率,如图2所示。
由图2可知:当上样体积为100~400 mL时,BPs的流出率为0~1.2%;当上样体积增大至500 mL时,BPs的流出率也增大,其中BPE和BPF的流出率分别为4.0%和6.1%;当上样体积为600 mL时,BPA、BPE、BPF和BPAF的流出率分别为2.5%,7.2%,13.9%和2.1%,BPF的流出率大于10%。上样体积的大小对水样中BPs分析方法的灵敏度有重要影响,上样体积越大,分析方法的灵敏度越高[3]。水环境样品中BPs含量较低,为了建立灵敏的分析方法测定环境水体中BPs的含量,试验在BPs流出率合理的情况下,选择较大的水样上样体积。因此,试验选择固相萃取中水样的上样体积为500 mL。
2.4 洗脱剂及其用量的选择
为选择最优洗脱剂种类,试验将90 mL的0.1 mg·L-1混合BPs水样进行上样,分别用甲醇、乙腈进行洗脱,每10 mL洗脱液接收一次,共接收5次(共50 mL)。从每段洗脱液中取1 mL置于2 mL塑料离心管中,在10 000 r·min-1的转速下离心2 min,取上清液用等体积水稀释,按照仪器工作条件测定。根据BPs峰面积计算回收率,以回收率为指标,比较不同洗脱剂的洗脱效果,结果见图3。
结果表明:当甲醇洗脱体积为10 mL时,BPs的回收率为77.8%~104%,8种BPs基本被完全洗脱;以乙腈为洗脱剂,当洗脱体积为10 mL时,回收率为43.3%~62.3%,大部分BPs的回收率未能满足试验要求。因此,试验选择洗脱效率较高的甲醇作为洗脱剂。
试验进一步对洗脱剂甲醇的用量进行优化。配制90 mL的0.1 mg·L-1混合BPs水样进行上样,用甲醇洗脱,每2 mL洗脱液接收一次,共接收6次,合计12 mL洗脱液。从每段洗脱液中取1 mL置于2 mL塑料离心管中,在10 000 r·min-1的转速下离心2 min,取上清液用等体积水稀释,按照仪器工作条件测定。根据BPs峰面积,计算回收率,以回收率为指标,选择最佳洗脱剂用量。结果表明:当甲醇用量为2 mL时,8种BPs的回收率为0~0.03%;当甲醇用量为4 mL时,8种BPs的回收率为52.4%~78.3%;当甲醇用量为6 mL时,8种BPs的回收率为72.2%~104%;继续增加洗脱剂用量至12 mL时,8种BPs的回收率基本不增加。因此,试验最终选择洗脱剂甲醇的用量为6 mL。
2.5 基质效应、工作曲线、检出限和测定下限
取一定量的10 mg·L-1BPF标准溶液,用甲醇或空白水样稀释,得到0.02,0.05,0.1,0.2,0.5,1 mg·L-1的BPF标准溶液系列或基质匹配的标准溶液系列。取一定量的10 mg·L-1的其余7种BPs单标准溶液,用甲醇或空白水样稀释,得到0.001,0.002,0.005,0.01,0.02,0.05,0.1 mg·L-1的其余7种BPs标准溶液系列或基质匹配的标准溶液系列。按照仪器工作条件测定,以BPs的质量浓度为横坐标,对应的峰面积为纵坐标分别绘制标准曲线和工作曲线。根据基质效应(ME)=工作曲线的斜率/标准曲线的斜率计算8种BPs的ME,结果见表2。由表2可知,8种BPs的ME值为0.92~1.65,BPE、BPF存在基质增强效应,其余6种BPs无明显的基质效应。因此,试验采用基质匹配的BPs标准溶液系列绘制工作曲线,以补偿基质效应对目标化合物的干扰,提高检测方法的准确度。得到的BPs工作曲线的线性范围、线性回归方程和相关系数见表2。
表 2 基质效应、线性参数、检出限和测定下限Table 2. Matrix effect, linearity parameters, detection limits and lower limits of determination化合物 ME值 线性范围ρ/(mg·L-1) 线性回归方程 相关系数 检出限ρ/(ng·L-1) 测定下限ρ/(ng·L-1) BPAF 0.99 0.001~0.1 y=4.388×105x−4.918×102 0.998 8 1.85 6.17 BPAP 0.92 0.001~0.1 y=9.859×104x−1.483×102 0.998 6 0.12 0.39 BPZ 0.94 0.001~0.1 y=3.221×104x−5.505×10 0.997 8 0.20 0.68 BPC 0.94 0.001~0.1 y=1.587×104x−4.087×10 0.999 1 9.00 30.00 BPB 1.01 0.001~0.1 y=5.454×104x−1.224×102 0.998 7 5.50 18.35 BPA 0.93 0.001~0.1 y=3.166×104x−5.797×10 0.997 0 6.94 23.12 BPE 1.36 0.001~0.1 y=2.429×104x−7.181×10 0.998 7 6.90 22.99 BPF 1.65 0.02~1 y=8.923×103x−4.102×102 0.998 1 10.50 34.99 按照3倍信噪比(S/N)计算检出限(3S/N),按照10倍信噪比计算测定下限(10S/N),结果见表2。
2.6 精密度和回收试验
对空白水样进行0.001,0.01 mg·L−1等2个浓度水平的加标回收试验,每个浓度水平制备5个平行样,计算回收率和测定值的相对标准偏差(RSD),结果见表3。由表3可知,8种BPs的回收率为73.3%~111%,测定值的RSD为1.4%~12%,说明方法的准确度和精密度良好。
化合物 加标量0.001 mg·L-1 加标量0.01 mg·L−1 回收率/% RSD/% 回收率/% RSD/% BPAF 97.2 6.0 86.9 5.1 BPAP 86.2 12 81.1 6.4 BPZ 84.0 8.5 93.8 6.9 BPC 101 6.2 95.4 2.7 BPB 97.8 6.6 87.9 3.6 BPA 111 7.3 86.2 1.4 BPE 97.7 1.8 99.7 3.1 BPF 73.4 1.4 73.3 4.8 2.7 方法比对
试验使用自填装的聚酰胺固相萃取柱,萃取500 mL环境水样中的8种BPs,随后用6 mL甲醇洗脱,过滤后直接采用HPLC-MS/MS检测。将本方法与文献报道的水中BPs的分析方法比较,结果见表4。
表 4 不同分析方法测定BPs的对比Table 4. Comparison of different analytical methods for BPs determination样品基质 目标物 前处理方法 分析方法 回收率/% 检出限ρ/(ng·L-1) 文献 环境水 BPAF、BPAP、BPZ、BPC、BPB、BPA、BPE、BPF 聚酰胺固相萃取→甲醇洗脱 HPLC-MS/MS 73.3~111 0.12~10.50 本方法 饮用水 BPA、BPAF、BPF、BPB、BPE C18固相萃取→乙腈/水洗脱→旋蒸浓缩 无水乙酸衍生化,气相色谱-质谱法(GC-MS) 89.0~115 0.29~4.2 [3] 饮用水 BPF、BPE、BPA、BPZ、四甲基双酚A 羧基化多壁碳纳米管固相萃取→甲醇洗脱 HPLC-紫外检测器 91.1~110 5~97 [5] 环境水 BPA 苯乙烯/二乙烯苯固相萃取→丙酮和二氯甲烷洗脱→旋蒸浓缩 三甲基氯硅烷和N,O-双(三甲基硅烷基)三氟乙酰胺衍生,GC-MS 103~110 24 [6] 包装饮用水 BPA、BPB、BPC、BPE、BPF、双酚S(BPS)、BPZ、BPAP、BPAF HLB固相萃取→乙酸乙酯/甲醇洗脱→氮吹浓缩 三甲基氯硅烷和N,O-双(三甲基硅烷基)三氟乙酰胺衍生,GC-MS 73.3~115 0.61~2.30 [7] 环境水 四氯双酚A、BPA、BPF、四溴双酚A C18固相萃取→二氯甲烷/丙酮洗脱→氮吹浓缩 HPLC-MS/MS 67.6~110 100~500 [8] 瓶装饮用水 BPA、BPS HLB固相萃取→甲醇洗脱→旋蒸浓缩 HPLC-MS/MS 95.9~102 5~20 [17] 饮用水 BPS、BPF、BPA 过滤后直接进样 HPLC-MS/MS 90.1~108 2~150 [18] 结果表明:HPLC-MS/MS可直接检测BPs,无需衍生化[3,6-7],省时省力;已报道的固相萃取方法中,C18[3,8]、HLB[7,17]、羧基化多壁碳纳米管[5]、苯乙烯/二乙烯苯聚合物[6]是常见的固相萃取剂,价格较为昂贵,本方法使用的聚酰胺是廉价易得的固相吸附材料,使用聚酰胺固相萃取法能在一定程度上降低成本;本方法只使用甲醇洗脱被聚酰胺吸附的BPs,无需配制混合洗脱剂[3,6-8]或使用毒性较高的二氯甲烷[6,8],操作简单、对环境友好;后续步骤中,本方法洗脱液可直接过滤进样,无需进行浓缩,节省时间。因此,与文献方法相比,本方法操作简单、成本较低,具有良好的回收率和较高的灵敏度,适用于环境水样中痕量BPs的定性定量分析。
2.8 实际环境水样的采集与检测
为验证方法的适用性,按照试验方法从广东省内11个城市(广州、深圳、东莞、珠海、湛江、清远、肇庆、惠州、韶关、揭阳、河源)随机采集33份水样,包括14份自来水、11份江河水、3份山泉水、2份水库水、2份湖水和1份井水。使用矿泉水瓶(聚对苯二甲酸乙二醇酯材质)采集水样并于48 h内运送至实验室,于采集后72 h内完成BPs的检测,结果见表5。检出量小于检出限的,则认为未检出BPs,记为“—”,以测定结果0参于平均质量浓度的计算;8种BPs平均质量浓度总和表示为∑BPs。
表 5 广东省内11个城市水样中BPs的测定结果Table 5. Determination results of BPs in water samples from 11 cities in Guangdong Province样品 采样地 测定值ρ/(ng·L−1) BPAF BPAP BPZ BPC BPB BPA BPE BPF 自来水1 东莞市大朗镇 - - - - - 340.05 - - 自来水2 湛江市雷州市 - 3.37 - - - 34.76 - - 自来水3 清远市清新区 104.12 - - 11.12 50.06 26.44 - - 自来水4 清远市清城区 - 7.79 - - - 12.02 - - 自来水5 惠州市傅罗县 - 1.15 - - - 97.47 - - 自来水6 韶关市新丰县 18.03 - - - - 22.34 - - 自来水7 韶关市武江区 3.34 0.85 - - - 17.10 - - 自来水8 深圳市龙岗区 - 17.19 1.59 9.77 - 339.34 - 13.70 自来水9 深圳市龙华区 - 2.54 0.25 - - 566.25 - - 自来水10 珠海市斗门区 1.87 1.28 - - - - - - 自来水11 广州市番禺区 18.03 - - - - 22.34 - - 自来水12 揭阳市普宁市 - - - - - 148.37 - - 自来水13 河源市紫金县 - - - - - 55.96 - - 自来水14 肇庆市端州区 - - - - - 104.16 - - 江河水1 清远市清新区 3.21 3.37 - - - - - - 江河水2 惠州市惠东县 - 6.43 2.58 11.89 - 593.21 - - 江河水3 惠州市惠东县 3.23 1.56 - 89.10 - 893.93 51.99 - 江河水4 惠州市傅罗县 - - - - - 431.22 - - 江河水5 惠州市傅罗县 2.84 - - - - 253.42 - - 江河水6 韶关市武江区 - 0.86 - - - 120.62 - - 江河水7 珠海市斗门区 - 0.45 - - - 118.49 - - 江河水8 广州市番禺区 - 0.19 - - - 69.83 - - 江河水9 揭阳市普宁市 6.13 - - - - 364.68 - - 江河水10 河源市紫金县 - - - - - - - - 江河水11 肇庆市端州区 - 0.19 - - - 276.98 - - 山泉水1 韶关市武江区 - - - - - 1 301.43 - - 山泉水2 肇庆市高要区 443.47 - - 81.45 210.30 22.34 - - 山泉水3 肇庆市鼎湖区 - - - - - 742.30 - - 水库水1 东莞市大朗镇 - 6.08 0.51 - - 70.30 - - 水库水2 湛江市雷州市 - - - - - 46.08 - - 湖水1 湛江市雷州市 - 0.86 0.93 - - 74.30 - - 湖水2 清远市清城区 - 9.10 - 23.63 - 2 411.52 - - 井水1 韶关市新丰县 1.95 0.64 - - - - - - 由表5可知:BPAF、BPAP、BPZ、BPC、BPB、BPA、BPE、BPF在33份水样中的检出率分别为33.33%,54.55%,15.15%,18.18%,6.06%,87.88%,3.03%,3.03%,平均质量浓度分别为18.37,1.94,0.18,6.88,7.89,290.22,1.58,0.42 ng·L−1,∑BPs为327.48 ng·L−1,可以看出BPA的检出率较高,认为是水样中的优势污染物,其次是BPAP与BPAF;14份自来水水样中BPAF、BPAP、BPZ、BPC、BPB、BPA、BPE、BPF的平均质量浓度为10.39,2.44,0.13,1.49,3.58,127.61,0,0.98 ng·L−1,∑BPs为146.62 ng·L−1,检出率为35.71%,50.00%,14.29%,14.29%,7.14%,92.86%,0,7.14%;19份未经自来水厂处理的水源中上述BPs的平均质量浓度依次为24.25,1.56,0.21,10.85,11.07,410.03,2.74,0 ng·L−1,∑BPs为460.71 ng·L−1,检出率为31.58%,57.89%,15.79%,21.05%,5.26%,84.21%,5.26%,0。由以上数据可知自来水厂处理过后的水样∑BPs比未经处理的水样更低。GB 5749—2022《生活饮用水卫生标准》附录A中BPA的限值为0.01 mg·L−1,其余BPs均未有国家限定标准,与该限值比较,33份水样中BPs的含量均未超标。
本工作优化了试验条件,以500 mL为上样体积,6 mL甲醇为洗脱剂,洗脱液直接过0.22 µm nylon针式过滤器,使用Acquity UPLC BEH C18色谱柱分离,结合HPLC-MS/MS测定广东省内33份水源水中8种BPs的含量。本方法操作方便,具有良好的准确度、精密度和灵敏度,对测定实际水样中BPs的含量有一定的现实意义。
-
表 1 质谱参数
Table 1 MS parameters
化合物 保留时间/min 母离子质荷比(m/z) 子离子m/z 去簇电压/V 碰撞能量/eV BPF 3.30 199.05 92.97*,199.55 54 22,20 BPE 4.13 213.06 197.96*,118.99 50 18,26 BPA 4.68 227.07 212.04*,132.98 46 18,26 BPB 5.30 241.07 212.00*,226.05 50 18,18 BPAF 5.63 335.02 265.01*,197.03 48 22,38 BPAP 5.65 289.10 274.03*,195.07 54 22,24 BPC 5.68 255.08 240.01*,147.03 58 20,28 BPZ 5.94 267.12 173.03*,223.17 66 26,32 表 2 基质效应、线性参数、检出限和测定下限
Table 2 Matrix effect, linearity parameters, detection limits and lower limits of determination
化合物 ME值 线性范围ρ/(mg·L-1) 线性回归方程 相关系数 检出限ρ/(ng·L-1) 测定下限ρ/(ng·L-1) BPAF 0.99 0.001~0.1 y=4.388×105x−4.918×102 0.998 8 1.85 6.17 BPAP 0.92 0.001~0.1 y=9.859×104x−1.483×102 0.998 6 0.12 0.39 BPZ 0.94 0.001~0.1 y=3.221×104x−5.505×10 0.997 8 0.20 0.68 BPC 0.94 0.001~0.1 y=1.587×104x−4.087×10 0.999 1 9.00 30.00 BPB 1.01 0.001~0.1 y=5.454×104x−1.224×102 0.998 7 5.50 18.35 BPA 0.93 0.001~0.1 y=3.166×104x−5.797×10 0.997 0 6.94 23.12 BPE 1.36 0.001~0.1 y=2.429×104x−7.181×10 0.998 7 6.90 22.99 BPF 1.65 0.02~1 y=8.923×103x−4.102×102 0.998 1 10.50 34.99 化合物 加标量0.001 mg·L-1 加标量0.01 mg·L−1 回收率/% RSD/% 回收率/% RSD/% BPAF 97.2 6.0 86.9 5.1 BPAP 86.2 12 81.1 6.4 BPZ 84.0 8.5 93.8 6.9 BPC 101 6.2 95.4 2.7 BPB 97.8 6.6 87.9 3.6 BPA 111 7.3 86.2 1.4 BPE 97.7 1.8 99.7 3.1 BPF 73.4 1.4 73.3 4.8 表 4 不同分析方法测定BPs的对比
Table 4 Comparison of different analytical methods for BPs determination
样品基质 目标物 前处理方法 分析方法 回收率/% 检出限ρ/(ng·L-1) 文献 环境水 BPAF、BPAP、BPZ、BPC、BPB、BPA、BPE、BPF 聚酰胺固相萃取→甲醇洗脱 HPLC-MS/MS 73.3~111 0.12~10.50 本方法 饮用水 BPA、BPAF、BPF、BPB、BPE C18固相萃取→乙腈/水洗脱→旋蒸浓缩 无水乙酸衍生化,气相色谱-质谱法(GC-MS) 89.0~115 0.29~4.2 [3] 饮用水 BPF、BPE、BPA、BPZ、四甲基双酚A 羧基化多壁碳纳米管固相萃取→甲醇洗脱 HPLC-紫外检测器 91.1~110 5~97 [5] 环境水 BPA 苯乙烯/二乙烯苯固相萃取→丙酮和二氯甲烷洗脱→旋蒸浓缩 三甲基氯硅烷和N,O-双(三甲基硅烷基)三氟乙酰胺衍生,GC-MS 103~110 24 [6] 包装饮用水 BPA、BPB、BPC、BPE、BPF、双酚S(BPS)、BPZ、BPAP、BPAF HLB固相萃取→乙酸乙酯/甲醇洗脱→氮吹浓缩 三甲基氯硅烷和N,O-双(三甲基硅烷基)三氟乙酰胺衍生,GC-MS 73.3~115 0.61~2.30 [7] 环境水 四氯双酚A、BPA、BPF、四溴双酚A C18固相萃取→二氯甲烷/丙酮洗脱→氮吹浓缩 HPLC-MS/MS 67.6~110 100~500 [8] 瓶装饮用水 BPA、BPS HLB固相萃取→甲醇洗脱→旋蒸浓缩 HPLC-MS/MS 95.9~102 5~20 [17] 饮用水 BPS、BPF、BPA 过滤后直接进样 HPLC-MS/MS 90.1~108 2~150 [18] 表 5 广东省内11个城市水样中BPs的测定结果
Table 5 Determination results of BPs in water samples from 11 cities in Guangdong Province
样品 采样地 测定值ρ/(ng·L−1) BPAF BPAP BPZ BPC BPB BPA BPE BPF 自来水1 东莞市大朗镇 - - - - - 340.05 - - 自来水2 湛江市雷州市 - 3.37 - - - 34.76 - - 自来水3 清远市清新区 104.12 - - 11.12 50.06 26.44 - - 自来水4 清远市清城区 - 7.79 - - - 12.02 - - 自来水5 惠州市傅罗县 - 1.15 - - - 97.47 - - 自来水6 韶关市新丰县 18.03 - - - - 22.34 - - 自来水7 韶关市武江区 3.34 0.85 - - - 17.10 - - 自来水8 深圳市龙岗区 - 17.19 1.59 9.77 - 339.34 - 13.70 自来水9 深圳市龙华区 - 2.54 0.25 - - 566.25 - - 自来水10 珠海市斗门区 1.87 1.28 - - - - - - 自来水11 广州市番禺区 18.03 - - - - 22.34 - - 自来水12 揭阳市普宁市 - - - - - 148.37 - - 自来水13 河源市紫金县 - - - - - 55.96 - - 自来水14 肇庆市端州区 - - - - - 104.16 - - 江河水1 清远市清新区 3.21 3.37 - - - - - - 江河水2 惠州市惠东县 - 6.43 2.58 11.89 - 593.21 - - 江河水3 惠州市惠东县 3.23 1.56 - 89.10 - 893.93 51.99 - 江河水4 惠州市傅罗县 - - - - - 431.22 - - 江河水5 惠州市傅罗县 2.84 - - - - 253.42 - - 江河水6 韶关市武江区 - 0.86 - - - 120.62 - - 江河水7 珠海市斗门区 - 0.45 - - - 118.49 - - 江河水8 广州市番禺区 - 0.19 - - - 69.83 - - 江河水9 揭阳市普宁市 6.13 - - - - 364.68 - - 江河水10 河源市紫金县 - - - - - - - - 江河水11 肇庆市端州区 - 0.19 - - - 276.98 - - 山泉水1 韶关市武江区 - - - - - 1 301.43 - - 山泉水2 肇庆市高要区 443.47 - - 81.45 210.30 22.34 - - 山泉水3 肇庆市鼎湖区 - - - - - 742.30 - - 水库水1 东莞市大朗镇 - 6.08 0.51 - - 70.30 - - 水库水2 湛江市雷州市 - - - - - 46.08 - - 湖水1 湛江市雷州市 - 0.86 0.93 - - 74.30 - - 湖水2 清远市清城区 - 9.10 - 23.63 - 2 411.52 - - 井水1 韶关市新丰县 1.95 0.64 - - - - - - -
[1] 许志刚,张小兰,刘智敏. 双酚类环境雌激素在水环境中的生态毒理、代谢及检测研究进展[J].昆明理工大学学报(自然科学版),2022,47(6):116-125. XU Z G ,ZHANG X L ,LIU Z M. Research progress on ecotoxicology,metabolism and detection of bisphenol environmental estrogens in water environment[J].Journal of Kunming University of Science and Technology(Natural Science Edition),2022,47(6):116-125.
[2] 许东海,谭学蓉,赵斌,等. 2020—2021年广元市主城区水源水和饮用水中双酚类化合物检测分析[J].预防医学情报杂志,2023,39(2):219-227. XU D H ,TAN X R ,ZHAO B ,et al. Analysis on the test results of bisphenol compound in source water and drinking water in main urban area of Guangyuan 2020 to 2021[J].Journal of Preventive Medicine Information,2023,39(2):219-227.
[3] CAO X L ,POPOVIC S. Solid phase extraction of large volume of water and beverage samples to improve detection limits for GC-MS analysis of bisphenol A and four other bisphenols[J].Food Additives & Contaminants Part A:Chemistry,Analysis,Control,Exposure & Risk Assessment,2018,35(1):49-55. [4] 刘洪媛,金静,郭崔崔,等. 环境样品中双酚类化合物的固相萃取研究进展[J].色谱,2021,39(8):835-844. LIU H Y ,JIN J ,GUO C C ,et al. Advances in solid-phase extraction for bisphenols in environmental samples[J].Chinese Journal of Chromatography,2021,39(8):835-844.
[5] 周同娜,尹海亮. 固相萃取-衍生化-气相色谱-质谱法同时测定环境水中双酚A和9种烷基酚类化合物的含量[J].理化检验-化学分册,2022,58(10):1182-1188. ZHOU T N ,YIN H L. Simultaneous determination of bisphenol A and 9 alkylphenols in environmental water by gas chromatography-mass spectrometry with solid phase extraction and derivatization[J].Physical Testing and Chemical Analysis Part B:Chemical Analysis,2022,58(10):1182-1188.
[6] ZHANG H F ,ZHANG Y P ,LI J B ,et al. Occurrence and exposure assessment of bisphenol analogues in source water and drinking water in China[J].Science of the Total Environment,2019,655:607-613. [7] 赵瑞霞,刘仲. 固相萃取-超高效液相色谱-质谱联用法检测水中14种环境激素的方法研究[J].中国卫生检验杂志,2021,31(23):2843-2847. ZHAO R X ,LIU Z. Determination of 14 environmental hormones in water by solid phase extraction-ultra performance liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Health Laboratory Technology,2021,31(23):2843-2847.
[8] 朱培杰,涂雪元,周家欢,等. 枪头式羧基化多壁碳纳米管固相萃取/高效液相色谱测定饮用水中双酚类化合物[J].分析测试学报,2021,40(9):1328-1333. ZHU P J ,TU X Y ,ZHOU J H ,et al. Determination of bisphenol compounds in drinking water by high performance liquid chromatography with pipette tip solid-phase extraction using carboxylated multi-walled carbon nanotubes as adsorbent[J].Journal of Instrumental Analysis,2021,40(9):1328-1333.
[9] GONG S X ,WANG X L ,LIU W ,et al. Aminosilanized magnetic carbon microspheres for the magnetic solid-phase extraction of bisphenol A,bisphenol AF,and tetrabromobisphenol A from environmental water samples[J].Journal of Separation Science,2017,40(8):1755-1764. [10] KHOLOVÁ A ,LHOTSKÁ I ,ERBEN J ,et al. Comparing adsorption performance of microfibers and nanofibers with commercial molecularly imprinted polymers and restricted access media for extraction of bisphenols from milk coupled with liquid chromatography[J].Talanta,2023,252:123822. [11] 王倩超支化聚酰胺-胺功能材料的制备及其对重金属的吸附研究吉首吉首大学2022王倩.超支化聚酰胺-胺功能材料的制备及其对重金属的吸附研究[D].吉首:吉首大学,2022. WANG QPreparation of hyperbranched polyamide-amine functional materials and their adsorption for heavy metalsJishouJishou University2022WANG Q. Preparation of hyperbranched polyamide-amine functional materials and their adsorption for heavy metals[D].Jishou:Jishou University,2022.
[12] 许蕤竹. 高效液相色谱测定食品中固绿的前处理方法对比研究[J].食品安全导刊,2023(12):68-70. XU R Z. Comparative study on pretreatment methods for determination of fast green FCF in food by high performance liquid chromatography[J].China Food Safety Magazine,2023(12):68-70.
[13] 唐海辉,周世帆,邹小明,等. 不同老化条件对聚酰胺6微塑料吸附磺胺噻唑的影响[J].环境污染与防治,2022,44(2):154-159. TANG H H ,ZHOU S F ,ZOU X M ,et al. Effects of different aging condition on the adsorption of sulfathiazole by polyamide 6 microplastic[J].Environmental Pollution & Control,2022,44(2):154-159.
[14] 董晓倩,白春蓉,兰韬,等. 快速滤过型净化结合液相色谱-蒸发光散射法检测茶叶中5种糖类成分[J].食品科学,2023,44(22):330-336. DONG X Q ,BAI C R ,LAN T ,et al. Determination of five saccharides in tea by multi-plug filtration cleanup combined with high performance liquid chromatography-evaporative light scattering detector[J].Food Science,2023,44(22):330-336.
[15] CHEN X X ,CHEN C E ,GUO X Y ,et al. Sorption and desorption of bisphenols on commercial plastics and the effect of UV aging[J].Chemosphere,2023,310:136867. [16] 宋作栋,仇雁翎,张华,等. 水体中双酚类物质的赋存现状及研究进展[J].环境化学,2020,39(6):1496-1503. SONG Z D ,QIU Y L ,ZHANG H ,et al. The occurrence and research progress of bisphenol analogues in aquatic environment[J].Environmental Chemistry,2020,39(6):1496-1503.
[17] 张媛媛,李延升,韩晓鸥,等. 固相萃取-超高效液相色谱-串联质谱法测定瓶装饮用水中双酚A、双酚S[J]. 食品安全质量检测学报,2018,9(9):2158-2163. ZHANG Y Y ,LI Y S ,HAN X O ,et al. Determination of bisphenol A and bisphenol S residues in bottled drinking water by ultra performance liquid chromatography-tandem mass spectrometry with solid phase extraction[J].Journal of Food Safety & Quality,2018,9(9):2158-2163.
[18] 周小新,胡小键. 超高效液相色谱串联质谱法测定饮用水中双酚S、双酚F和双酚A[J].环境卫生学杂志,2020,10(2):196-200. ZHOU X X ,HU X J. Direct determination of bisphenol S,bisphenol F,and bisphenol A in drinking water by ultra-performance liquid chromatography-mass spectrometry[J].Journal of Environmental Hygiene,2020,10(2):196-200.



 下载:
下载: